前沿 | 超过90%ALGS患者获得缓解,创新口服疗法Bylvay获FDA优先审评资格;罕见病新药「尼替西农」在中国获批
中国罕见病联盟
超过90%ALGS患者获得缓解,创新口服疗法Bylvay获FDA优先审评资格 2月14日,美国FDA接受创新疗法Bylvay(odevixibat)的补充新药申请(sNDA)并授予其优先审评资格,用于治疗Alagille综合征(ALGS)患者。 Alagille综合征(ALGS)是一种罕见的多系统遗传疾病,该病会累及肝脏、心脏、骨骼、眼睛、中枢神经系统、肾脏和面部等。大约95%的患有这种疾病的
超过90%ALGS患者获得缓解,创新口服疗法Bylvay获FDA优先审评资格
2月14日,美国FDA接受创新疗法Bylvay(odevixibat)的补充新药申请(sNDA)并授予其优先审评资格,用于治疗Alagille综合征(ALGS)患者。
Alagille综合征(ALGS)是一种罕见的多系统遗传疾病,该病会累及肝脏、心脏、骨骼、眼睛、中枢神经系统、肾脏和面部等。大约95%的患有这种疾病的患者通常在出生后的三个月内出现慢性胆汁淤积,多达88%的患者还出现严重的顽固性瘙痒症。
Bylvay(odevixibat)是一种强效的非系统性回肠胆汁酸转运抑制剂(IBATi),全身暴露量小,在小肠局部起作用。ASSERT是一项双盲、随机、安慰剂对照试验,旨在评估Bylvay在缓解ALGS患者瘙痒症方面的安全性和有效性。3期ASSERT研究的积极数据表明,Bylvay提供了早期、快速、具有临床意义和持续的瘙痒缓解,超过90%的患者瘙痒获得缓解,还观察到胆汁酸水平的显著降低及睡眠质量的改善。且患者对Bylvay的耐受性良好。
Bylvay(odevixibat)获得了治疗PFIC、ALGS、胆道闭锁和原发性胆道胆管炎的孤儿药专有权。
(来源:Albireo Pharma)
PMG1015获美国FDA孤儿药资格认定,用于治疗特发性肺纤维化
2月17日,在研新药PMG1015被美国FDA授予孤儿药资格认定(Orphan Drug Designation, ODD),用于治疗特发性肺纤维化(IPF)。
特发性肺纤维化(Idiopathic Pulmonary Fibrosis, IPF)是一种进行性肺纤维化疾病,起病隐匿、病情渐进加重,症状表现为进行性肺功能恶化,呼吸困难,活动耐量下降,严重影响患者生活质量。患者确诊后中位生存时间为2-4年,因此IPF也被称为“不是癌症的癌症”。 迄今为止FDA仅批准上市了吡非尼酮和尼达尼布两个治疗IPF的药物,这两个药物虽可减缓肺功能下降,但副作用严重,患者经常因为副作用而降低用量甚至停药。
PMG1015是一款单克隆抗体药物,用于治疗特发性肺纤维化。在澳洲和中国完成的Ia期临床试验均证实了其优秀的安全性和耐受性,目前正在中国积极推进在IPF患者人群中开展的Ib期临床试验。
(来源:普沐生物)
罕见病新药「尼替西农」在中国获批
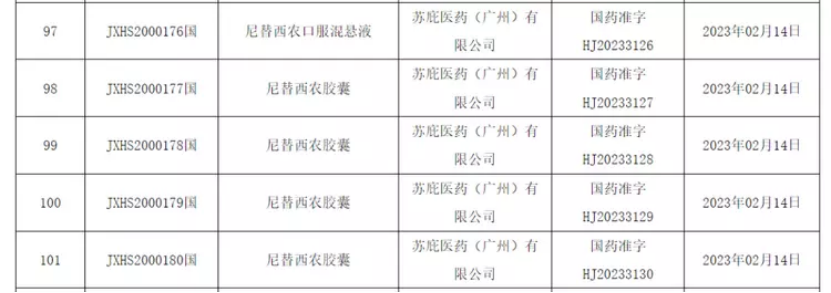
2月20日,中国国家药监局(NMPA)发布的药品批准证明文件显示,尼替西农原研药已在中国获批上市。
1型酪氨酸血症是一种常染色体隐性遗传的罕见病,由15号染色体基因缺陷导致,以进展性肝衰竭、肝细胞癌风险增加、凝血障碍、痛性神经危象、肾小管功能障碍导致佝偻病为特征。大多数患儿在出生后6个月出现急性型病症,在1岁内表现出急性肝衰竭、反复出血等症状,具有较高的死亡风险。
尼替西农是一种4-羟苯丙酮酸双氧酶竞争性抑制剂,可抑制1型酪氨酸血症患者酪氨酸的正常代谢,预防代谢中间体的累积,避免毒性代谢物造成的肝肾毒性。是国际上治疗1型酪氨酸血症(HT-1)的首选药物。2020年12月,该药的上市申请获中国国家药品监督管理局药品审评中心(CDE)受理,并被纳入优先审评。该药本次获批了口服混悬液和胶囊两个剂型,本次申请的适应症为:结合酪氨酸和苯丙氨酸饮食限制,用于治疗成人和儿科患者(任何年龄阶段)的遗传性酪氨酸血症1型。中国1型酪氨酸血症患者将迎来更多的治疗选择。
(来源:国家药品监督管理局官网)


