专家笔谈 | 中国罕见病药品审评审批的改革与发展
中国罕见病联盟
罕见病对社会、经济、乃至医疗体系构成了不容忽视的深远影响。罕见病药物的研发之路尤为艰难。由于患者群体小、市场需求有限,医药企业在药物研发上往往缺乏足够的动力与资源投入,加之研发周期长、成本高、风险大,使得许多潜在的治疗药物在研发初期便夭折。本文总结了国家药品监督管理局针对罕见病这一重要的公共卫生问题所采取的一系列鼓励政策,以及近年来罕见病药物审评审批的成果。正是这些政策加速了药监部门的审批速度,在确保药品安全有效的前提下,为罕见病患者带来了更多的治疗选择与希望。随着政策环境的不断优化与研发技术的不断进步,未来中国药监部门将继续围绕罕见病临床需求,实践“以患者为中心”的药物研发理念,为罕见病药物研发注入新活力,为罕见病患者带来更加精准、有效的治疗选择。
目前全球已知的罕见病种类超过7000种[1],这些疾病的发病率极低,然而,由于中国人口基数庞大,罕见病患者的绝对数量不容小觑。据估计,中国罕见病患者人数约为2000万以上。在这些罕见病患者中,80%的患者患有先天遗传性疾病,50%是儿童[2]。这些疾病严重影响了患儿的生长发育,甚至可能导致未成年夭折,即使成年,也可能丧失社会功能,生活质量极低。由于单病种的患者数量较少,患者个体很容易成为“孤岛”,给诊断和治疗带来了极大的挑战。
许多罕见病目前仍缺少有效的治疗药物。医学界对这些疾病的认知相对有限,这使得罕见疾病的药物研发面临着比常见多发疾病更大的困难。例如,罕见病药物临床试验受试者的招募往往困难重重。又如,罕见病药物的研发投入巨大,但经济收益相对较低,这导致有些企业罕见病药物的研发投入意愿低。
中国政府近年来高度重视罕见病。《2023年政府工作报告》[3]提出“加强罕见病研究、诊疗服务和用药保障”。针对罕见病药物的研发,药品监管部门出台了多项政策,旨在加快促进罕见病创新药物的研发进程,尽早满足罕见病患者的迫切治疗需求。在国家政策的引导下,中国罕见病药物的研发和审评情况正在逐步发生积极的变化,为罕见病患者带来更多的治疗选择和希望。
1 多项罕见病药物研发鼓励政策相继出台
2015年8月,国务院印发《关于改革药品医疗器械审评审批制度的意见》[4],2017年10月,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[5],提出“加快审评审批防治艾滋病、恶性肿瘤、重大传染病、罕见病等疾病的创新药”,以及“支持罕见病治疗药品医疗器械研发”,全面启动了审评审批改革计划,要求监管机构在确保药品安全有效的前提下,进一步加快罕见病药物的审评审批速度。
2018年5月,国家药品监督管理局和国家卫生健康委员会联合发布了《关于优化药品注册审评审批有关事宜的公告》[6],公告中明确提出,针对罕见病药品,药品审评中心(Center for Drug Evaluation, CDE)将建立与申请人的沟通交流机制,加强对药品研发的指导。
2019年修订的《中华人民共和国药品管理法》[7],作为中国药品监管的基本法律,明确提出要鼓励短缺药品的研制和生产,并对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药予以优先审评审批。这一法律的颁布为加快和鼓励罕见病药物研发提供了坚实的法律基础。随后,2020年1月药品监管部门发布了《药品注册管理办法》[8],并相继出台了一系列工作程序,进一步细化和落实了《中华人民共和国药品管理法》中的相关要求。
在加快罕见病药物审评审批的同时,有关部门加强协同联动,为满足罕见病临床用药开辟多通道,包括:支持海南博鳌乐城国际医疗旅游先行区、粤港澳大湾区医疗机构临床急需药品进口政策;支持北京天竺综合保税区设立罕见病药品保障先行区;2022年,国家卫生健康委员会、国家药品监督管理局发布《临床急需药品临时进口工作方案》和《氯巴占临床进口工作方案》[9],保障氯巴占等罕见病药品的临床需求。
这些变革不仅激发了市场活力,还为中国罕见病药物研发领域注入了新的发展动力(表1)。为落实相关政策,国家药品监督管理局完善对罕见病药物的评审与核准流程,支持罕见病药物研发全面提速。
1.1 加强沟通交流
为了加强与药品研发企业的沟通协作,提倡在罕见病药物的研发初期,企业主动与监管部门交流,共同规划临床研发计划。对于儿童用药和罕见病用药的沟通交流,CDE在接到企业申请后,将迅速组织召开Ⅰ类会议,通常在30个工作日内完成,这一速度明显快于Ⅱ类会议(60个工作日)和Ⅲ类会议(75个工作日)。
1.2 审评审批提速
2018年,国家药品监督管理局发布了《关于调整药物临床试验审评审批程序的公告》[17],其中明确规定了药物注册临床试验将采用许可模式进行审批,CDE将自临床试验申请(investigational new drug,IND)受理之日起60个工作日内决定是否同意开展药物临床试验。尽管这项制度并非罕见病药物的特有制度,但随着默示许可制度的推行,为罕见病药物临床试验的推进及全球同步研发提供了重要保障。

根据《药品注册管理办法》,罕见病药物可被纳入优先审评审批程序,对于纳入优先审评审批范围的注册申请,将在审评、检查、审批等各个环节优先配置资源,以加快审评审批的速度,因此新药上市申请(new drug application,NDA)的评审时间已从常规程序的200个工作日缩短至130个工作日。
1.3 鼓励创新,进一步推动有临床价值的新药研发和上市
除上述优先审评审批程序以外,《药品注册管理办法》还设立了突破性治疗药物认定机制,进一步加速药物研发进程。2020年7月,国家药品监督管理局发布了《突破性治疗药物审评工作程序(试行)》[16],明确规定符合特定条件的罕见病药物可以纳入突破性治疗药物程序。一旦被认定为突破性治疗药物,将有机会在NDA时获得优先审评审批资格,并在药物临床研发期间获得与CDE召开沟通交流Ⅰ类会议的机会。此举为罕见病药物提供了更多审评资源,加速其研发进程。
1.4 以患者为中心,提升药物可及性
为缩短国内外临床实践的差距,国家药品监督管理局于2018年7月发布了《接受药品境外临床试验数据的技术指导原则》[15]。对于境外已上市的罕见病药品,进口药品注册申请人若经研究认为不存在人种差异,可直接提交境外取得的临床试验数据以申报药品上市注册申请。这些政策的出台,显著缩短了境外已上市新药在中国市场的上市时间,有效提升了国内罕见病患者治疗药物的可及性。
自2018年起,部分进口罕见病药物的快速上市得益于“临床急需境外新药名单”的发布。在国家药品监督管理局和国家卫生健康委员会于2018年10月23日发布《临床急需境外新药审评审批工作程序》[18]之后,CDE于2018年11月1日公布了第一批临床急需境外新药名单[19]。随后,2019年和2020年相继发布了第二批和第三批临床急需境外新药名单[20-21]。被列入名单的药物品种,可按照《临床急需境外新药审评审批工作程序》[18]提交相关资料,直接提出上市申请,CDE为其建立了专门的快速审评通道。从受理新药申请到批准的时限被严格控制在70个工作日内。
2 罕见病药物研发与上市提速,惠及中国患者
经过多年努力,中国针对罕见病药物研发的各项鼓励措施已见成效。为了解2015年全面启动审评审批改革的影响,本文对2015年至2024年6月期间国家药品监督管理局CDE审评系统中,所申报适应症涉及罕见病的新药、改良型新药、境外已上市境内未上市药品的仿制药、境外已上市境内未上市进口药的注册申报情况进行了统计分析。
2.1 临床试验申请审评情况
2015年至2024年6月期间,CDE共批准罕见病药物(以《罕见病目录》[22-23]疾病为适应症,或适应症中包含《罕见病目录》中疾病)临床试验853项,其中国产药物为548项,进口药305项。审评用时随着临床试验默示许可制的落地实施大幅缩短,在2019年以前,审评所用的中位时间为192个工作日,而在2019年之后,审评所用的中位时间为50个工作日。
审评速度的提升促进了罕见病药物研发效率,客观上也提升了药物研发单位的研发热情,从历年批准的罕见病临床试验数量上看,自2020年起有明显增高(图1),尤其是国产药临床试验数量大幅增加。另一方面,在305项进口药物的IND中,1类新药共148项,这表明中国的进口罕见病药物,从滞后引进逐步走向全球同步研发。
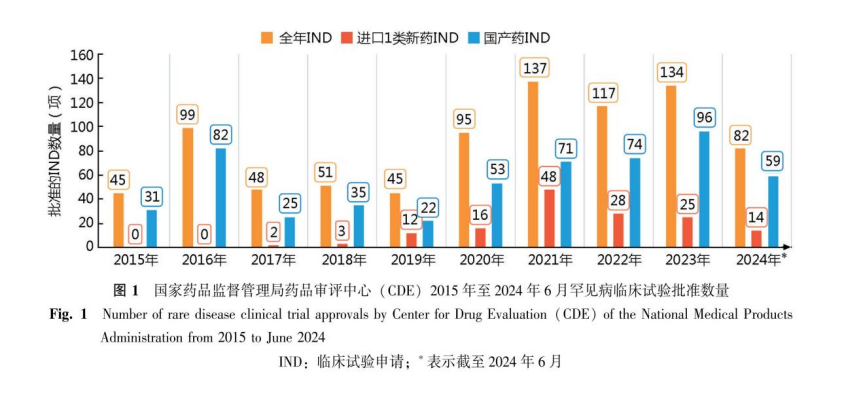
2.2 上市申请审评情况
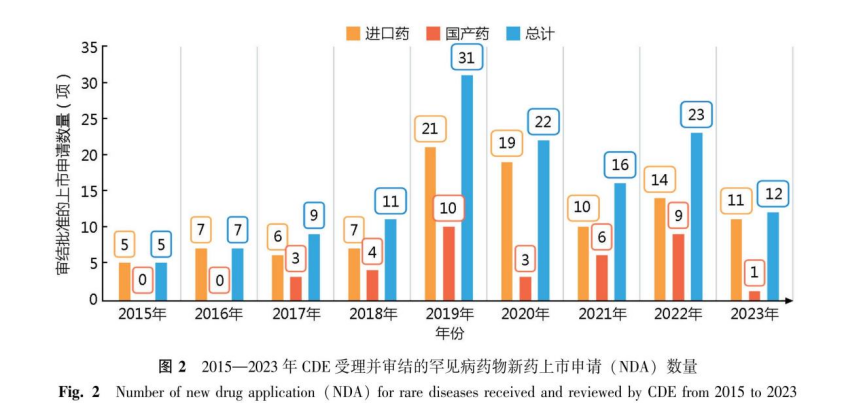
在NDA申请方面,自2015—2023年,CDE共受理并审结通过的罕见病药品上市申请136项,其中化学类药品53项,治疗用生物制品83项;国产药品上市申请36项,进口药品上市申请100项。自2015年起,罕见病领域的NDA整体呈现递增趋势(图2)。
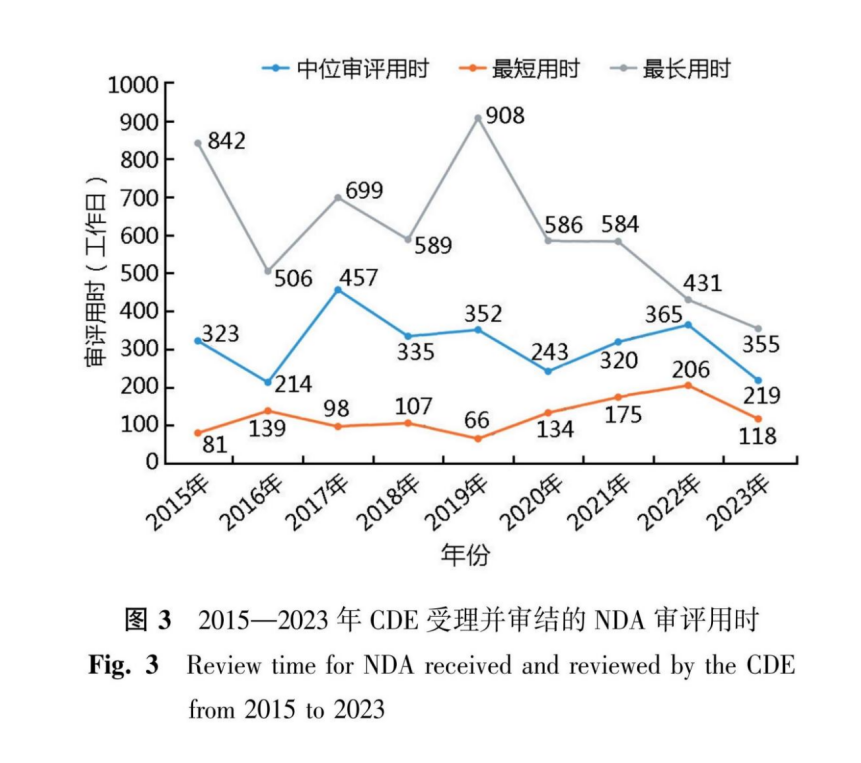
NDA的审评速度也有明显提升。自2015—2023年期间受理的上市申请审评整体用时(以CDE受理日期至最终审结日期间的工作日计算),中位审评用时较为稳定,而历年受理品种的最长审评用时有比较明显的缩短。审评整体用时中包括了发补后申请人补回用时,以及核查、检验等时间,反映了从NDA受理后,监管机构技术审评实际占用的时间(图3)。
3 技术评价体系的建设
罕见病药物的研发难度远超其他药物。一方面,罕见病治疗药物的上市需获得充分的证据,证明其对患者的获益大于风险,这是药品监管机构批准药物上市的基本前提。另一方面,由于罕见病患者人数较少,疾病类型复杂且病死率高,开展罕见病药物临床试验面临诸多挑战,如患者入组困难、诊断难度大、终点指标复杂,以及研究周期长等。药品监管机构必须科学构建技术评价体系,为罕见病药物研发提供指导。
为此,CDE制定了一系列指导原则。自2021年起,CDE先后发布了《罕见疾病药物临床研发技术指导原则》[24]、《罕见疾病药物临床研究统计学指导原则》[25]、《罕见疾病药物开发中疾病自然史研究指导原则》[26]、《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》[27]及《罕见病基因治疗产品临床试验技术指导原则》[28]等多项指导文件。
4 推动“以患者为中心”的罕见病药物研发
疾病给患者带来的生理、心理和生活方面的困扰,患者的治疗期望和实际需求,以及治疗可能带来的改善或负担,都是患者自身最为关切的问题;然而,医务人员、研发人员、医药企业及监管机构对这些方面的了解并不充分。因此,药物研发“以患者为中心”的理念,正逐渐受到各方的重视。在药物研发过程中,各方必须充分倾听患者的声音,关注患者的视角和需求,以此为导向开展药物研发工作,以期更好地实现药物研发的核心目标——满足患者的治疗需求。
围绕“以患者为中心”的药物研发理念,CDE相继发布了《以患者为中心的药物临床试验设计技术指导原则(试行)》《以患者为中心的药物临床试验实施技术指导原则(试行)》《以患者为中心的药物获益-风险评估技术指导原则(试行)》[29]及《组织患者参与药物研发的一般考虑指导原则》[30]等多项指导原则,以规范药物研发流程,确保患者的权益和利益。
在实际工作中,CDE持续进行创新与尝试。例如,审评员曾多次参与国家儿童医学中心北京儿童医院举办的针对血友病患儿的活动,通过深入接触,充分倾听患者心声,了解其生活与医疗需求。此外,CDE还与多家研究机构和药物研发企业展开交流合作。例如,与北京协和医院临床药理中心进行调研座谈,共同探讨模型引导的罕见病药物研发在中国的实施难点;再如,与中国罕见病联盟及药物研发单位代表召开研讨会,深入了解研发单位在罕见疾病药物研发中所面临的挑战与困惑。
为进一步推进“以患者为中心”的罕见病药物研发工作,CDE已开展一项名为“关爱计划”(“关爱”,即“CARE”,代表:patient-Centered Action for Rare diseases Encouragement)的试点工作[31]。该计划的主要目标是以罕见疾病为重点,将“以患者为中心的药物研发”理念落到实处。通过加强监管机构、药物研发单位和患者等各方在罕见疾病药物研发过程中的沟通与合作,在药物研发的全过程中充分引入罕见疾病患者的观点,倾听患者的声音,切实提高罕见疾病患者在药物研发过程中的参与度和影响力。目前,该项目已正式启动,期望在试点项目取得经验的基础上,未来能够形成一套成熟的、可推广的工作方法和流程,使更多中国患者的声音能够被纳入罕见病药物研发,包括全球研发的进程中。
5 结语
良好的政策是激励药物创新研发的重要动力。对罕见病而言,尤为重要。在政策的推动下,中国的罕见病药物研发和审评状况正逐步发生积极变化。一方面,越来越多的医药企业开始关注罕见病领域,加大研发投入力度。医药企业利用先进的生物技术、基因编辑技术等手段,不断探索新的治疗路径与方法。另一方面,药品监管部门也在不断优化审评流程、提高审评效率,通过建立快速通道、实施优先审评等措施,为罕见病药物的上市提供了有力保障。
未来,中国罕见病药物研发不仅要满足中国罕见病患者的临床治疗需求,还应当努力走出国门,提高各国罕见病患者的药物可及性。中国药监部门要继续围绕罕见病临床需求,实践“以患者为中心的药物研发”理念,缩小国内外临床实践差距,推动“关爱计划”实施,为罕见病药物研发注入新活力。
作者贡献:黄果、杨志敏负责本文构思及撰写;唐凌、张杰、艾星、色日格楞、赵田负责数据收集及分析。
利益冲突:所有作者均声明不存在利益冲突。
参考文献
[1]Orphanet. 2016 Activity report[EB/OL].(2017)[2024-08-06]. http://www.orpha.net/orphacom/cahiers/docs/GB/ActivityReport2016.pdf.
[2]Wright CF, FitzPatrick DR, Firth HV. Paediatric genomics: diagnosing rare disease in children[J]. Nat Rev Genet,2018,19(5):253-268.
[3]国务院. 2023年政府工作报告[EB/OL].(2024-03-12)[2024-10-07].https://www.gov.cn/yaowen/liebiao/202403/content_6939153.htm.
[4]国务院.国务院关于改革药品医疗器械审评审批制度的意见(国发〔2015〕44号)[EB/OL]. (2015-08-18)[2024-08-06].https://www.gov.cn/zhengce/content/2015-08/18/content_10101.htm.
[5]中共中央办公厅,国务院办公厅.中共中央办公厅 国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[EB/OL].(2017-10-08)[2024-10-07].https://www.gov.cn/zhengce/2017-10/08/content_5230105.htm.
[6]国家药品监督管理局, 国家卫生健康委员会. 国家药品监督管理局 国家卫生健康委员会关于优化药品注册审评审批有关事宜的公告(2018年第23号)[EB/OL].(2018-05-17)[2024-08-06].https://www.nmpa.gov.cn/directory/web/nmpa/zhuanti/ypqxgg/ggzhcfg/2018052311060 1517.html.
[7]第十三届全国人民代表大会常务委员会.中华人民共和国药品管理法[EB/OL].(2019-08-27)[2024-09-07].https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20190827083 801685.html.
[8]国家市场监督管理总局.药品注册管理办法[EB/OL].(2020-01-22)[2024-10-04].https://www.gov.cn/gongbao/content/2020/content_5512563.htm.
[9]国家卫生健康委员会,国家药品监督管理局.关于印发《临床急需药品临时进口工作方案》和《氯巴占临时进口工作方案》的通知(国卫药政发〔2022〕18号)[EB/OL].(2022-06-23)[2024-10-07].https://www.gov.cn/zhengce/zhengceku/2022-06/30/content_5698580.htm.
[10]原国家食品药品监督管理总局. 国家食品药品监督管理总局关于药品注册审评审批若干政策的公告(2015年第230号)[EB/OL].(2015-11-11)[2024-10-07].https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/
ypggtg/ypqtggtg/20151111120001229.html.
[11]国务院办公厅.国务院办公厅关于印发深化医药卫生体制改革2016年重点工作任务的通知(国办发〔2016〕26号)[EB/OL].(2016-04-21)[2024-10-07].https://www.gov.cn/zhengce/content/2016-04/26/content_5068131.
htm.
[12]国务院. 国务院关于印发“十三五”卫生与健康规划的通知(国发〔2016〕77号)[EB/OL].(2016-12-27)[2024-10-07].https://www.gov.cn/zhengce/content/2017-01/10/content_5158488.htm.
[13]原国家食品药品监督管理总局,科技部. 关于加强和促进食品药品科技创新工作的指导意见[EB/OL].(2018-01-30)[2024-10-07].https://www.gov.cn/xinwen/2018-01/30/content_5262107.htm.
[14]国务院办公厅. 国务院办公厅关于改革完善仿制药供应保障及使用政策的意见(国办发〔2018〕20号)[EB/OL].(2018-03-21)[2024-10-07].https://www.gov.cn/gongbao/content/2018/content_5283184.htm.
[15]国家药品监督管理局. 国家药品监督管理局关于发布接受药品境外临床试验数据的技术指导原则的通告(2018年第52号)[EB/OL].(2018-07-06)[2024-10-07].https://www.nmpa.gov.cn/zhuanti/ypqxgg/ggzhcfg/20180710151401465.html.
[16]国家药品监督管理局. 国家药监局关于发布《突破性治疗药物审评工作程序(试行)》等三个文件的公告(2020年第82号)[EB/OL].(2020-07-07)[2024-10-07].https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/202007081 51701834.html.
[17]国家药品监督管理局.国家药品监督管理局关于调整药物临床试验审评审批程序的公告(2018年第50号)[EB/OL].(2018-07-27)[2024-08-06].https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ywlchshyjgrdgg/20180727172901 286.html.
[18]国家药品监督管理局, 国家卫生健康委员会.国家药品监督管理局 国家卫生健康委员会关于临床急需境外新药审评审批相关事宜的公告(2018年第79号)[EB/OL].(2018-10-23)[2024-08-06].https://www.nmpa.gov.cn/zhuanti/ypqxgg/ggzhcfg/20181030171201646.html.
[19]国家药品监督管理局药品审评中心.关于发布第一批临床急需境外新药名单的通知[EB/OL].(2018-11-01)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/21de8acd6c395746b041b2ad93eb5c43.
[20]国家药品监督管理局药品审评中心.关于发布第二批临床急需境外新药名单的通知[EB/OL].(2019-05-29)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/82f3bf94dc2c38d1a24d851f0e44914b.
[21]国家药品监督管理局药品审评中心.关于发布第三批临床急需境外新药名单的通知[EB/OL].(2020-11-19)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/08818b168ccc85db9a42a0f6623b5688.
[22]国家卫生健康委员会, 科学技术部, 工业和信息化部,等.关于公布第一批罕见病目录的通知(国卫医发〔2018〕10号)[EB/OL]. (2018-05-11)[2024-08-06].http://www.gov.cn/zhengce/zhengceku/2018-12/31/content_5435167.htm.
[23]国家卫生健康委员会, 科技部, 工业和信息化部, 等.关于公布第二批罕见病目录的通知(国卫医政发〔2023〕26号)[EB/OL].(2023-09-18)[2024-08-06].https://www.gov.cn/zhengce/zhengceku/202309/content_6905273.htm.
[24]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《罕见疾病药物临床研发技术指导原则》的通告(2021年第71号)[EB/OL].(2021-12-31)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/c4e1ef312a0a0c039a7a4ca55b91d4e8.
[25]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《罕见疾病药物临床研究统计学指导原则(试行)》的通告(2022年第33号)[EB/OL].(2022-06-02)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/058e0d665b785e79b7f4f24dc1dc970c.
[26]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《罕见疾病药物开发中疾病自然史研究指导原则》的通告(2023年第43号)[EB/OL].(2023-07-27)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/beef37b41b0a2d10b72ba1465a7a19e1.
[27]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》的通告(2024年第25号)[EB/OL].(2024-05-30)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/e5b3409ea38fbc8254
bb0635d004c73d.
[28]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《间充质干细胞防治移植物抗宿主病临床试验技术指导原则》《罕见病基因治疗产品临床试验技术指导原则》的通告(2024年第7号)[EB/OL].(2024-01-18)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/08bd57e996a5e9de6f920f626d9ab149.
[29]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布 《以患者为中心的药物临床试验设计技术指导原则(试行)》《以患者为中心的药物临床试验实施技术指导原则(试行)》《以患者为中心的药物获益-风险评估技术指导原则(试行)》的通告(2023年第44号)[EB/OL].(2023-07-27)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/42c008e28f7004cd19b73949142380bd.
[30]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布 《组织患者参与药物研发的一般考虑指导原则(试行)》的通告(2022年第46号)[EB/OL].(2022-11-21)[2024-08-06].https://www.cde.org.cn/main/news/viewInfoCommon/41c7a683e4d0dcca28bccadc47096d2a.
[31]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》的通知(药审业〔2024〕500号)[EB/OL].(2024-09-13)[2024-09-15].https://www.cde.org.cn/main/news/viewInfoCommon/244dc3661a 418359aa12d7cba9bacf5d.


