罕见病政策研究 | 中国罕见病法律制度现状与对策
罕见病联盟
罕见病防治是中国重要的公共卫生问题。由于其呈现种类多、患者多、病情复杂和负担重等特点,无论从公民个人健康还是国家宏观责任层面,罕见病防治衍生的系列问题均亟待解决。立法是促进罕见病多病种防治和患者多层次保障的有效途径。本文基于对中国国家和地方层面罕见病相关法律制度的梳理和分析,从立法的整体性、规范性和可行性3个维度,提出完善和优化罕见病防治法律制度体系的对策建议,以期增强中国罕见病防治能力和患者保障水平。
罕见病是发病率低、患者总数相对较少的一类疾病的总称,其诊疗难度大、疾病负担重,是威胁人类整体健康福祉的重大公共卫生问题[1]。由于人口基数大、优质医疗资源分布不均等国情,罕见病在中国并不“罕见”,呈现出疾病种类多、单病种患者少、总体患者多、病情复杂和疾病负担重等特点。罕见病多病种的有效防治和患者的多层次保障日益受到社会的关注。规范的制度是促进中国罕见病防治及患者保障水平的有力举措,完善的法制是制度有效、系统和持续运行的重要保障。然而,目前中国罕见病防治及患者保障在规范制度构建方面仍有待完善:一是相关制度规范呈现“碎片化”特征,例如,与罕见病预防相关的产前筛查规定在《母婴保健法》中,而罕见病患者的用药保障规定则在《药品管理法》中;二是部分规范内容有待完善且效力层级不高,例如,现有法律规范尚未回应罕见病患者除诊疗用药之外的照护和康复需求;三是明确有效的体制机制支撑尚待加强,各部门协同不充分、 责任机制有待明确,使得现有分散化的制度规范对患者的持续性保障能力稍显不足,更需要全方位有效回应患者需求。因此,如何有效整合“碎片化”的罕见病法律规范,以高位阶立法明确权责并规范实施程序,是当前中国罕见病防治和患者权益保障的关键。
1中国罕见病领域立法现状
1.1国家层面的罕见病立法现状
中国对于罕见病的关注及研究主要体现在医学领域,以基础和临床研究为主[2]。目前,国家层面尚未明确制定针对罕见病或罕见病用药的系统性法律法规和支持性政策,相关内容仍散见于不同位阶的法律文本。本文以时间发展为顺序,梳理了涉及罕见病/罕见病用药政策的主要法律法规(表1)。
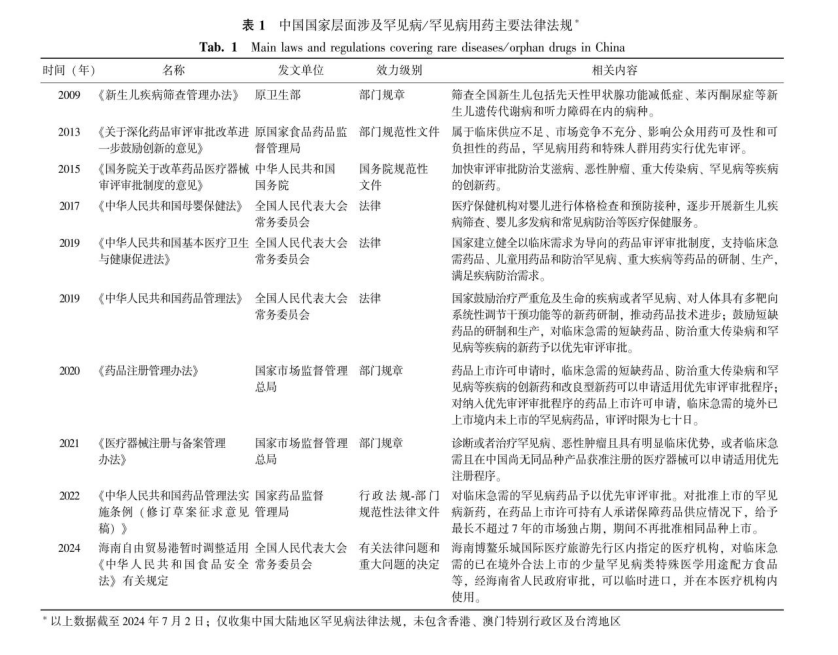
1.2地方层面的罕见病立法现状
地方层面对于罕见病立法规制的探索,主要体现在医疗服务水平、诊疗规范和用药保障机制的建设上。浙江省、山东省和江苏省是省级层面发布罕见病相关规范性文件最多的省份,其中江苏省更是在省级地方性法规中明确建立罕见病用药保障机制。此外,多数地方性探索的内容均围绕罕见病用药保障机制的指导与规范,包括特定高值药品的统筹、准入和待遇,但就病前筛查、社会基本医疗服务、康复及照护等仍涉及较少。见表2。

2中国罕见病领域立法问题和挑战
整体而言,中国罕见病领域的法律体系仍处于建构的起步阶段,其理论基础与配套建设均尚未完善[3]。中国的法律文本中最早出现“罕见病”和“罕见病新药”是在1999年发布的《药品注册管理办法》,但至今对其具体的法律概念尚无书面共识。此后数年,罕见病大都与艾滋病、恶性肿瘤等统称为“疑难危重疾病”,出现在国家层面的卫生健康立法中,加以“支持”“鼓励”的笼统性政策指导;或者在药品器械类部门规章及规范性文件中,涉及推进新药研发、减少或免做临床试验,以及加快审评审批进度、实行特殊审批等。
目前,中国在罕见病领域的法律尚不健全,存在多方面的问题和挑战,具体如下。
第一,立法路径与内容尚待明确。罕见病立法是一项系统的复杂工程,其中关键点之一即是对罕见病疾病概念的界定[1]。罕见病的概念不仅是对罕见病疾病事实的描述,也体现了国家对其特定社会价值考虑的承认与共识[4]。多数罕见病患者面临超高的治疗和照护负担,为有效保障该群体的健康权益,需要社会公共资源的倾斜与共同救助。然而,在立法方面,罕见病患者权益的保障仍有部分问题需要解决。首先,就立法内容而言,侧重点在于用药保障,还是集诊疗、用药、康复为一体的多层次保障?其次,就立法形式而言,究竟是“小切口”立法增强针对性,还是“兜底式”全覆盖?是采取嵌入其他部门法的章节式立法还是单独立法?最后,法律位阶又应处于何种位置?这些问题均有待实践的进一步探讨和证明。
第二,罕见病管理体系尚待完善。目前罕见病和罕见病用药的相关管理更多以专家委员会政策建议为主,尚未设置分工明确的执法机构与管理部门。同时,中国有待建立清晰的罕见病药品认定程序,而不是仅在优先审评审批程序中作为一种类型进行申报[5-6]。这在一定程度上限制了罕见病保障措施的推进与罕见病用药专属审评审批的通道构建。此外,全国性的数据协同仍难以打破信息渠道的区域壁垒。2019年,国家卫生健康委员会组织开发中国罕见病诊疗服务信息系统,并要求诊疗协作网成员医院对应开展罕见病病例诊疗信息登记工作[7]。对于罕见病诊疗的整体把控,不仅需要国家相关卫生部门的牵头布局,更需要包括各级医院在内的利益相关方紧密交流以达成良性互动与合作。
第三,罕见病用药政策激励不足。由于罕见病用药研发上市过程中试验范围小、疗效未知,政府对罕见病和罕见病用药的政策倾斜力度亟待提升。目前为止,尚无专门针对罕见病用药研发的资金投入政策,科学研究的经费主要来自国家自然科学基金[8],罕见病用药上市后的市场激励相对有限。在资源配置的考虑方面,如何平衡卫生保健其他领域与罕见病用药研发的资金需求[9],仍需讨论。同时,对基因检测及治疗技术等学科发展前沿的关注仍需提升。中国在2003年批准了全球首个基因治疗产品gendicine,虽起步较早,但与同期的美国和欧洲相比进展缓慢,目前国内仅有8家企业的基因治疗产品获批临床[10]。预计至2030年将有40~60种基因治疗药物上市,可造福35万患者[11],中国理应跻身研发行列。
第四,社会保障体系相对滞后。罕见病以药物治疗为主,由于市场规模小、投资风险高等因素,制药企业将研发精力投入罕见病领域意愿低。截至2022年末,全球在研的罕见病药品共5215种,而中国在研的罕见病药物共840种,年均增长率虽达34%,但仍与国际研发环境存在差距[12]。罕见病的治疗药物通常定价高,患者一药难求。尽管一些试点城市如山东青岛、浙江宁波、广东深圳等已取得了局部的罕见病保障进展,但全国范围内仍未建立统一的罕见病保障政策。罕见病的医疗保障主要依靠大病医疗保险、补充医疗保险、医疗救助和慈善捐赠等[13],商业健康保险和医疗互助制度等尚未发挥作用。如何合理分担患者高昂的诊疗和药物费用,缓解其“因病致贫,因病返贫”的困境,仍需探索。
3中国罕见病法律制度构建的对策及建议
科学立法是社会治理现代化的重要依据与手段,其核心在于立法观念与立法方式的双重科学性[14]。通过法规立项论证,尊重研究对象的内在规律,有效保障立法观念和方式规范合理。整体性、规范性和可行性是法规立项论证的三大衡量维度[15],以此构建论证为支撑,可进一步完善中国罕见病法律制度的对策建议。
3.1整体性与规范性构建论证
法之整体性,重点在总量控制、综合平衡下的立法资源整合。回顾中国以往立法经验,在针对一类低经济水平、低健康水平的弱势人群立法层面,曾相继出台《中华人民共和国妇女权益保障法》《中华人民共和国残疾人保障法》等法律;在针对具体的疾病人群立法层面,《中华人民共和国传染病防治法》《中华人民共和国职业病防治法》也可视作先例。基于此,罕见病作为一类发病率低、诊疗困难、治疗费用昂贵的疾病,罕见病患者作为一类风险高、病情重、回归社会困难的人群,在人群关注需求度和疾病威胁程度上与残疾人群、高危职业病人群等表现出同样较高的脆弱性,有必要为这类疾病及患者群体制定相应的法律。
法之规范性,重点在充实基础、衔接有效下的立法内容完备。近年来,中国有多项罕见病立法与防治体系相关议案提请人大审议,如2021年十三届全国人民代表大会第四次会议审议的《通过“三医”联动建立罕见病防治体系》、2022年十三届全国人民代表大会第五次会议审议的《关于进行罕见病诊疗及管理立法的议案》等,议案的提交与审议引发各界热议。国务院亦在2022年和2024年的政府工作报告中,两度提出加强罕见病相关研究及其用药保障。然而,无论是议案还是政府工作报告,关注的重点是罕见病患者权益保障的某一特定维度,如诊疗路径、用药保障等,尚未进行系统性政策探索和保障机制的构建。一部基础性、综合性、统领性的立法,可在规范性层面,为系统性的政策探索和保障机制的构建提供指导。因此,为契合民主立法、科学立法精神,全面提升中国罕见病诊疗及管理水平,罕见病立法已是势在必行。
3.2可行性构建论证
3.2.1立法过程:形式实际与可操作
就立法流程的过程可行性而言,其一是需考虑立法依据是否充分,即已有的、较为成熟的前期实践或经验措施。鉴于历往在各级法律文件和政策文本中对罕见病(罕见病用药)相关措施零散涉及的这一基础,步骤上可遵循“循序渐进”的系统性原则。收集地方先行示范,诸如浙江省曾在2019年发布《关于建立浙江省罕见病用药保障机制的通知》,是国内首个将罕见病保障纳入省级统筹医疗保障制度的省份。统筹经验,以国务院办公厅文件的形式,就中国大陆地区罕见病诊疗管理及权利保障等做出系统规定;进而以国务院出台行政法规的形式,制定罕见病条例;待经验积累完备与时机成熟后,上升至全国人大及其常务委员会的具体草案。其二,在全社会价值考量和社情民意的基础上,进行立法效果的预期评估及风险评估,经由社会多方意见征询,颁布真正蕴含中国智慧的罕见病防治系列法规。
3.2.2立法内容:价值评估与可执行
就立法的内容可行性,重点在于明确所需要解决的社会问题,并讨论其是否具体可行。作为重新分配权利、义务和责任的活动,立法首要是衡量价值观念之博弈,对于罕见病患者“实质平等”与健康权保障呼声的平衡,是第一宗旨。其次是科学上的可评估[16],即在微观上进行系统拆解,以支撑整体法律制度的运行,具体如罕见病管理组织的权责明确与罕见病用药研发激励等。最后在于立法后的可执行[16],完善罕见病患者筹资来源,鼓励多渠道沟通,倡导社会通力合作,切实以法之导向为罕见病患者开辟可见可行的保障路径。
(1)立足国情,以保障公民生命健康为宗旨。罕见病,既是国民健康权利与社会共同风险规制的公共议题,也在于维护因少而难、因病而弱[3]的公民个体权利。因而,在全球以立法保障罕见病患者的浪潮之中,中国势必整合各方力量,交出蕴含中国特色的答卷。本文建议立法重视中国现阶段的政治经济国情,结合传统中国“以人为本”的文化背景,强调以保障公民生命健康与国家公共卫生安全为宗旨,完善与现阶段经济社会发展水平相适应的立法进程。同时立法中坚持以科学诊断、治疗、预防罕见病为目的,以此作为整个罕见病和罕见病用药法律体系的根基,进而在时间和空间上全面致力于缩减、协调罕见病患者在获得医疗服务资源、医疗保障范围[4]、社会再就业权益等方面产生的“事实上不平等”状态,最大限度地帮助罕见病患者获得科学合理诊疗,及时回归社会。
(2)机构设置,明确组织管理注重多方协同。基于罕见病患病人群处境之艰、用药之急的双重特殊性,多方分散的管理显然不利于满足医疗服务需求与提高用药可及性。目前,国家卫生健康委员会下设罕见病诊疗与保障专家委员会,负责提供罕见病相关的政策意见与技术支持。同时在政府支持下,中国国家罕见病注册系统、罕见病临床队列研究和国家罕见病网络已成为关键的科学知识库[17]。建议立法在进一步规范该专家委员会运行机制的同时,在国家药品监督管理局药品审评中心下设专门的罕见病用药资格认定机构,划拨与罕见病用药相关的各项审评审批程序到专业的药物审评队伍中,以提高罕见病用药的上市效率。其次,注重全国性罕见病信息系统的建立与完善,强化各类数据信息及专业智库的多方渠道汇总职能,以帮助决策者及时掌握国内罕见病诊疗服务情况,从而作出科学决策。
(3)政策导向,激励罕见病药物研发及上市。在罕见病用药市场,合理有效的政策激励措施所带来的正面影响不可估量。建议在罕见病立法中,针对罕见病用药与器械的研发及上市全过程,设置激励措施以调动多方利益相关者合力,使更多安全有效的罕见病用药适时在国内得到上市权限,满足罕见病患者的用药需求。面对境内无药的现状,国家应大力构建良好政策环境,通过临床急需境外新药名单,将国际已上市的治疗相关适应证的罕见病用药纳入优先审评审批程序,缩短时长以快速进入中国市场。面对全球无药的现状,国家更应制定“加大科研经费投入、放宽临床试验要求、加速审批流程、上市后适度减免税收、允许合理市场独占期,以及拓宽与国际药企合作渠道”等一系列的政策激励,引导国内的制药企业进入罕见病用药研发上市行列。同时,持续关注、适时参与基因治疗等前沿科技治疗手段,为罕见病国内市场注入活力。
(4)社会保障,满足患者需求凝聚关爱共识。立法保障罕见病患者权利,是考虑其弱势存在,同时也是致力于消除其弱势的存在。首先,对于困扰罕见病患者及其家庭的费用支付问题,本文建议在立法中完善罕见病诊疗多渠道资金筹集体系,不仅依靠传统的医疗保险支撑与商业保险辅助,同时应鼓励社会筹资与企业赠药等第三方主体积极参与。满足差异化、多样性的健康需求,解决各类保险尚未渗透的区域,通过全社会共同分担,以规避患者及其家庭“因病致贫”风险。其次,20世纪80年代以来,国际上罕见病患者群体的行动主义增加了公众的关注。建议倡导患者组织、新闻媒体多方合作开展与罕见病有关的社会宣传和反歧视倡导,提升罕见病患者、家属和公众群体对罕见病的理解和认知。
4结语
罕见病不仅是医学领域的问题,更是整个社会所面临的公共卫生治理问题。需以立法为基石,推动制定罕见病领域的纲领性法律法规,并促进其系统化,从国家层面覆盖罕见病及罕见病用药的管理、研发激励和社会关怀等方面,形成多位一体的治理格局,切实保障罕见病患者的健康权益。
作者贡献:谢诗瑶负责检索文献、撰写与修订论文;刘子钰负责辅助撰写与修订论文;李顺平提出选题思路、修订意见并审校论文。
利益冲突:所有作者均声明不存在利益冲突。
参考文献
[1]杨殿政,许文秀,李壮琪,等. 罕见病及罕见病用药械法律界定研究[J]. 中国新药杂志,2020,29(23):2647-2653.
[2]马正,高嘉敏,赵艺皓,等. 罕见病政策国际经验及对我国的启示[J]. 中国卫生政策研究,2018,11(11):61-67.
[3]程岩. 罕见病法律制度的困境与出路[J]. 河北法学,2011,29(5):10-18.
[4]宋华琳. 以立法破解罕见病保障困局——构建更加公平更可持续的罕见病法律制度[N]. 中国医药报,2022-02-28.
[5]蒋蓉,邵蓉. 美国罕见病药物资格认定管理政策分析及对我国的启示[J].中国食品药品监管,2020(4):88-93.
[6]朱晓红,李顺平,陈敬丹,等. 罕见病药品资格认定的国际实践与启示[J].罕见病研究,2022,1(3):339-346.
[7]张文,许莹,张欣欣,等.我国罕见病健康数据监测平台的建设现状及展望[J].现代医院,2023,23(9):1317-1319.
[8]莫昕,程峰. 境外罕见病法律和保障体系与我国现状的对比分析[J]. 中国药事,2017,31(2):182-188.
[9]Drummond M,Towse A. Orphan drugs policies:a suitable case for treatment[J]. Eur J Health Econ,2014,15(4):335-340.
[10]Wang D,Wang K,Cai Y. An overview of development in gene therapeutics in China[J]. Gene Ther,2020,27(7-8):338-348.
[11]Quinn C,Young C,Thomas J,et al. Estimating the clinical pipeline of cell and gene therapies and their potential economic impact on the US healthcare system[J]. Value Health,2019,22(6):621-626.
[12]王肖雲. 罕见病治疗:药物研发的现状、面临的挑战与突破机遇[EB/OL].(2024-04-28)[2024-07-22].https://www.cmtopdr.com/post/detail/d325d218-4c34-47ce-ba41-
73817db49df9.
[13]王子琪,闵连星,田兴军,等. 我国罕见病医保政策的现状及优化路径[J]. 卫生经济研究,2021,38(11):22-25.
[14]卫凯博,江国华. “社会治理现代化”背景下科学立法的事实证明——基于立法立项的分析[J]. 河北法学,2024,42(1):132-149.
[15]闫鹏涛.地方性法规立项论证要“过五关”[EB/OL]. (2011-09-30)[2023-12-19]. https://www.npc.gov.cn/c2/c189/c7266/201905/t20190523_64564.html.
[16]于兆波. 立法必要性可行性的理论基础与我国立法完善——以英国立法为视角[J]. 法学杂志, 2014,35(11):55-63.
[17]Zhang S,Chen L,Zhang Z,et al. Orphan drug develop-ment in China:progress and challenges[J]. Lancet,2019,394(10204):1127-1128.


