论著 | 416例性发育异常患者临床表现、分子遗传学及性腺病理分析
中国罕见病联盟
目的探讨性发育异常(DSD)患者临床表现、分子遗传学及性腺病理特点,总结从常见症状中发现罕见病的临床经验。方法回顾性分析2018年5月至2023年8月在广州医科大学附属妇女儿童医疗中心DSD多学科中心诊疗的416例DSD患者的临床资料,归纳统计与讨论。结果416例DSD患者按照染色体核型分类:性染色体核型异常者92例(22.1%)、46,XY核型者285例(68.5%)和46,XX核型者39例(9.4%)。92例性染色体核型异常患者中,按男性抚养59例,主诉阴茎短小合并尿道下裂及隐睾18例(30.5%);92例中最常见核型是45,X/46,XY,共58例(63.0%)。285例染色体核型46,XY患者中,按男性抚养238例,主诉阴茎短小合并尿道下裂63例(26.5%);按女性抚养47例,主诉腹股沟包块13例(27.7%)。216例46,XY核型患者进行全外显子组检测,发现155例(71.8%)存在与临床表型相符的分子致病原因。39例染色体核型46,XX患者按男性抚养19例,主诉阴茎短小合并尿道下裂8例(42.1%),性腺活检18例,显示性腺含睾丸组织者17例,行全外显子组测序14例中发现NR5A1基因杂合变异、SRY基因变异和SOX3基因变异各2例(均14.3%);按女性抚养20例,主诉阴蒂肥大14例(70.0%),性腺活检8例,活检显示卵睾7例(87.5%),发现NR5A1基因杂合变异1例(14.3%)。结论DSD患者病因复杂多样,临床表现异质性大,可以表现为尿道下裂、小阴茎、隐睾等泌尿系统常见症状体征,不同病因的治疗抉择不同,因此,可以通过染色体核型、分子遗传学检测及性腺病理等检查明确病因,尤其对于罕见病,可提高检出率减少漏诊率,确保合理治疗,尤其是性别选择。
性发育异常(disorders of sex development,DSD)是性染色体、性腺、内/外生殖器官三者性别不一致的一大类遗传异质性疾病的总称,临床上DSD的临床表现异质性大,可表现为尿道下裂、小阴茎、隐睾和性反转等。尿道也是男性外生殖器官,其发育遵循性发育规律。尿道下裂是男性儿童泌尿系统最常见的先天性畸形,发病率为1.39‰~9.03‰[1],也是罕见DSD常见的临床表现。但其发病原因查找常被忽略,而相关治疗往往需要精准的病因诊断。现就 416例DSD患者进行临床资料收集、数据统计与讨论,总结从常见症状体征中发现罕见病的临床经验,现报道如下。
1资料与方法
1.1一般资料
选取2018年5月至2023年8月于广州医科大学附属妇女儿童医疗中心多学科诊疗中心确诊的416例DSD患者作为对象,进行回顾性研究。本研究经过广州医科大学附属妇女儿童医疗中心医学伦理委员会批准同意(项目编号:2015-112)和患者知情同意。
1.2方法
1.2.1临床资料收集
(1)病史和体格检查。详细询问患者病史和体格检查并记录,病史包括一般病史、发育史、母亲妊娠期用药史和家族史,体格检查包括全身检查、第二性征和外生殖器检查。
(2)实验室和影像学检查。对患者进行实验室和影像学检查,其中实验室检查包括性激素[如黄体生成素、卵泡刺激素、睾酮、雌二醇、双氢睾酮、血清抗苗勒管激素(anti-Mullerian hormone,AMH)、抑制素B、催乳素]、肾上腺皮质激素[如皮质醇、促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)]、促性腺激素释放激素、人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)激发试验、外周血染色体核型、染色体微阵列分析和全外显子组测序;影像学检查包括肾上腺、盆腔内生殖器和性腺超声,以及下丘脑垂体核磁共振。
(3)手术探查和性腺活检。对符合性腺活检指征的患者进行腹腔镜或开放手术下内生殖器、性腺探查及性腺上下极活检行病理免疫组化。
(4)外周血全外显子组测序。在广州医科大学附属妇女儿童医疗中心检测并分析,结合疾病遗传模式和患者临床表型进行综合分析,筛选出可疑候选变异。参考基因组为GRCh37/hg19,变异遵循HGVS命名规则(http://varnomen.hgvs.org/);利用PCR和Sanger测序验证分析,并对父母等家系成员进行分别验证。通过美国医学遗传学与基因组学学会/分子病理学协会(American College of Medical Genetics and Genomics and the Association for Molecular Pathology,ACMG/AMP) 的指南对变异进行致病性分类。其中对于变异位点的检索参考人类基因变异数据库(Human Gene Mutation Database,HGMD)和ClinVar最新的更新数据,检索截止日期为2023年11月30日。
1.2.2判断标准
(1)DSD判断标准:①性腺或生殖器性别与染色体性别不一致;②男性化不全:阴茎短小、尿道下裂、隐睾、阴囊分裂、阴茎阴囊转位;③女性化不全:阴蒂肥大,阴唇融合、闭经;④女性男性化:声音低沉,出现喉结、胡须、腿毛;⑤外生殖器性别难辨;⑥青春期年龄无第二性征发育或出现与性别不相符的第二性征发育;⑦排除肾上腺肿瘤、性腺肿瘤,以及应用性激素类药物致外生殖器和第二性征异常。
(2)单纯阴茎短小判断标准:阴茎牵拉长度(stretched penile length,SPL)小于正常同龄人群的阴茎长度平均值2.5标准差以上者,阴茎外观形态和解剖结构正常,无尿道下裂、女性化特征等表现[2]。
(3)青春期延迟判断标准:①女性14岁仍无乳房发育;②男性16岁仍无胡须、喉结、变声、腋毛、阴毛、阴茎增大增粗、睾丸增大和遗精。
1.2.3性腺活检指征
具体包括:①性染色体异常,特别是含Y染色体女性表型或男性化不全的性染色体嵌合体;②染色体核型与相关激素检测无法获得一致诊断,须依赖于性腺组织学检测的情况;③染色体核型和外生殖器无法获得一致诊断,须依赖于性腺组织学检测的情况;④SRY基因变异;⑤常规检查无法探及性腺,必须依赖开放手术或腹腔镜探查,并获得患者或其监护人知情同意。
1.3统计学分析
采用SPSS 26.0统计学软件进行分析,用Shapiro-Wilk进行数据正态性检验,各类计量资料均不符合正态分布,用中位数(P25,P75)表示,计数资料采用[n(%)] 进行描述。
2结果
2.1一般情况
416例患者均符合DSD上述判断标准,按男性抚养316例(316/416,76.0%),女性抚养100例(100/416,24.0%)。就诊年龄最小1月龄,最大18岁,平均2岁10月龄(中位数),其中婴儿期(≤1岁)103例(103/416,24.7%),幼儿期(>1岁和≤3岁)113例(113/416,27.2%),学龄前期(>3岁和≤6岁)62例(62/416,14.9%),学龄期(女性:>6岁和≤11岁;男性:>6岁和≤12岁)54例(54/416,13.0%),青春期(女性:>11岁和≤18岁;男性:>12岁和≤20岁)84例(84/416,20.2%)。
2.2染色体核型
全部患者均行染色体核型检查。结果显示,性染色体核型异常者92例(92/416,22.1%),见表1;46,XY核型 285例(285/416,68.5%);46,XX核型 39例(39/416,9.4%)。

2.3性染色体核型异常患者临床表型、分子遗传学及性腺活检结果
92例性染色体核型异常者,就诊年龄最小1月龄,最大18岁,平均5岁(中位数);按男性抚养59例(59/92,64.1%);按女性抚养33例(33/92,35.9%)。主要特征见表2。

59例按男性抚养的性染色体核型异常者均含有Y染色体和/或+mar染色体,行性腺活检40例,结果显示发育不良睾丸30例(30/40,75.0%),睾丸恶变1例;卵睾8例(8/40,20.0%),睾丸正常2例(2/40,5.0%)。性腺为卵睾的8例患者,染色体核型为45,X/46,XY和46,XX/46,XY者各4例。1例染色体核型为46,XY/47,XXY者,同时检测出SRD5A2基因c.680G>A(p.Arg227Gln)纯合致病变异,表现为阴茎短小合并双侧隐睾,性腺病理提示正常发育睾丸,HCG激发试验显示睾酮升高36.3倍,睾酮/双氢睾酮=39.6。1例染色体核型为46,XY/47,XYY者检测出AR基因c.170_172dupTGC(p.Leu57dup)半合致病变异,表现为阴茎短小,性腺病理显示发育不良睾丸,HCG激发睾酮升高71.6倍。
33例按女性抚养的性染色体核型异常者除45,X 2例,45,X/46,XX 1例,45,X/46,Xadd(X)(p22)1例外,其余29例染色体均含有Y染色体和/或+mar染色体。行性腺活检29例,结果显示条索状性腺18例(18/29,62.1%),恶变1例;卵睾5例(5/29,17.2%),恶变3例;发育不良睾丸5例(5/29,17.2%);正常卵巢1例(1/29,3.5%)。1例染色体核型为47,XXY者检测出NR5A1基因杂合移码致病变异,外生殖器似女性,内生殖器探查无子宫、输卵管。性腺病理为发育不良睾丸,AMH 5.1 ng/mL,ACTH为3.64 pmol/L,HCG激发睾酮升高1.17倍。
2.4染色体核型46,XY患者临床表型、分子遗传学及性腺活检结果
285例染色体核型为46,XY患者,就诊年龄最小1月龄,最大17岁10月,平均2岁7月龄(中位数);按男性抚养238例(238/285,83.5%);按女性抚养47例(47/285,16.5%)。主要特征见表3。
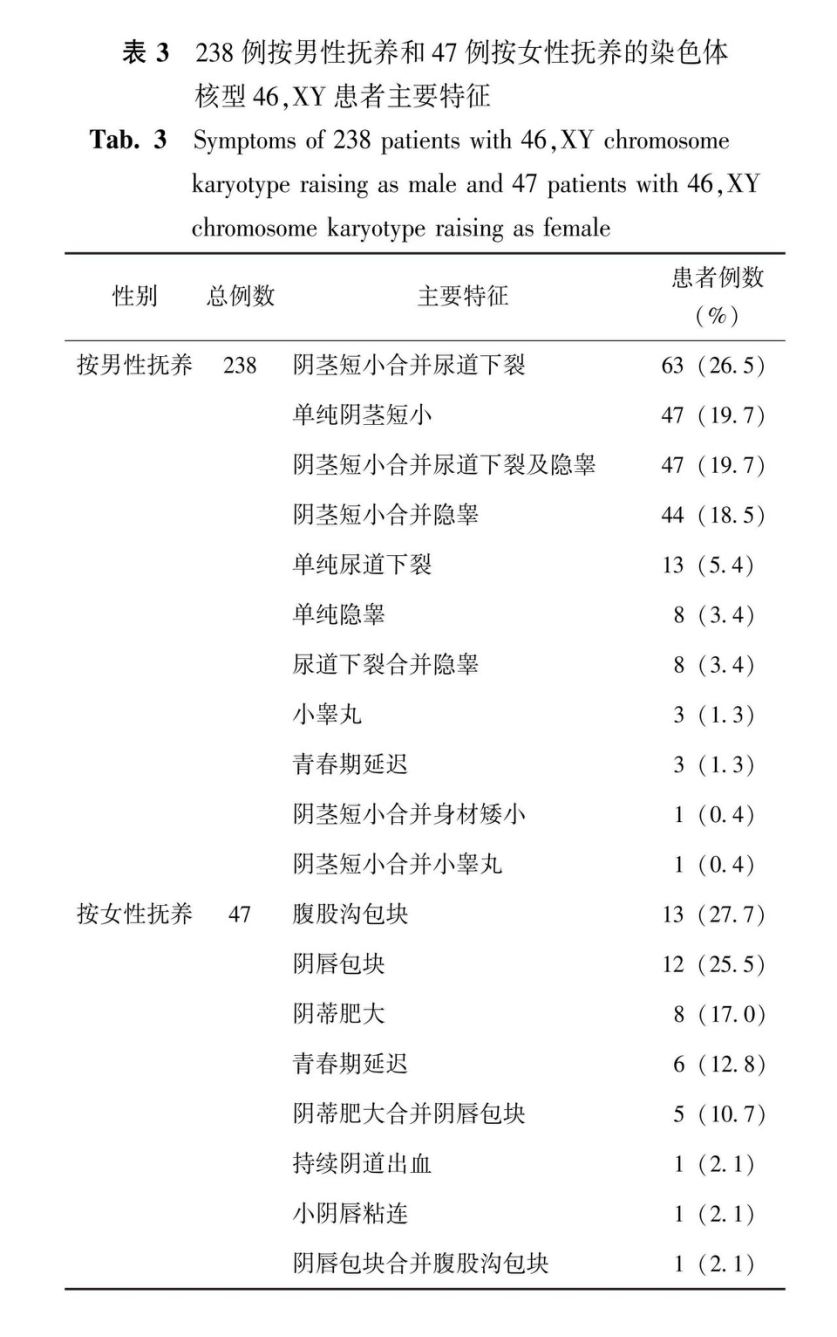
238例按男性抚养的染色体核型46,XY患者中行性腺活检59例,结果显示睾丸发育不良38例(38/59,64.4%),睾丸恶变2例;睾丸正常11例(11/59,18.6%),条索状性腺5例(5/59,8.5%),卵睾5例(5/59,8.5%)。性腺为卵睾的5例患者中,1例全外显子组测序发现PPP1R12A基因c.736_738delGAA(p.Glu246del)自发杂合变异。
47例按女性抚养的染色体核型46,XY患者均行全外显子组测序,结果显示AR基因半合致病变异18例(18/47,38.3%),SRD5A2基因双等位基因致病变异11例(11/47,23.5%),NR5A1基因杂合致病变异7例(7/47,14.9%),
10q染色体微缺失、PBX1基因变异、HSD173B基因变异、CYP17A1基因变异、DMRT1基因变异、DHX37基因和CYP11B1基因双变异各1例(均分别为1/47,2.1%),原因不明5例(5/47,10.7%)。行性腺活检24例,睾丸发育不良21例(21/24,87.5%),睾丸恶变2例;卵睾3例(3/24,12.5%)。性腺为卵睾的3例患者中,2例为AR基因半合致病变异:c.2495G>A(p.Arg832Gln)及c.2390G>A(p.Trp797*)。
285例染色体核型为46,XY患者中,获得患者或其监护人知情同意下,216例进行全外显子组检测,结合患者临床表现、性激素结果及影像学检查结果,确认155例(155/216,71.8%)患者存在与临床表型相符的分子致病原因,性腺(睾丸)发育障碍相关基因25例(25/155,16.1%)、激素合成或作用障碍相关基因114例(114/155,73.6%)、其他综合征14例(14/155,9.0%)及双基因2例(2/155,1.3%)。见表4。


2.5染色体46,XX患者临床表型、分子遗传学及性腺活检结果
39例染色体核型为46,XX患者,就诊年龄最小4月龄,最大14岁,平均2岁9月龄(中位数);按男性抚养19例(19/39,48.7%),按女性抚养20例(20/39,51.3%)。主要特征见表5。获得患者或其监护人知情同意下,39例染色体核型为46,XX患者中25例进行全外显子组检测,结合患者临床表现、性激素结果及影像学检查结果,确认单基因致病性变异13例(13/25,52.0%),共5个疾病基因。

19例按男性抚养的染色体核型46,XX患者中行性腺活检18例,卵睾9例(9/18,50.0%),发育不良睾丸7例(7/18,38.8%),正常睾丸1例(1/18,5.6%),正常卵巢1例(1/18,5.6%)。性腺有睾丸组织的17例患者中,行全外显子组测序14例,发现NR5A1基因杂合变异、SRY基因变异和SOX3基因变异各2例(均为2/14,14.3%),未检出基因致病变异8例(8/14,57.1%)。
按女性抚养的20例患者中行性腺活检8例,卵睾7例(7/8,87.5%),正常卵巢1例(1/8,12.5%)。
7例卵睾患者,均行全外显子组测序,发现NR5A1基因杂合变异1例(1/7,14.3%),未检出基因致病变异6例(6/7,85.7%)。
3讨论
2006年Lawson Wilkins儿科内分泌学会和欧洲儿科内分泌学会首次提出“性发育异常”一词,且按照染色体核型将DSD分为性染色体异常DSD、46,XY DSD和46,XX DSD三大类[3]。性发育分为两个独立的、连续的阶段,包括性别决定阶段和性别分化阶段[4]。性别决定是指具有双向分化潜能的原始性腺分化成为睾丸或卵巢;性别分化是指在性腺产生的激素作用下生成男性或女性内外生殖器。性发育过程有严格的时间顺序,精细调控,过程复杂,任何偏离一个既定的环节,都可能导致DSD、尿道下裂、小阴茎、隐睾和性反转等。
本研究发现DSD患者就诊年龄跨度大,其中婴儿期103例(103/416,24.7%),幼儿期113例(113/416,27.2%),婴幼儿期就诊者超过一半。其中阴茎短小、尿道下裂等临床表现明显的患者会在出生后不久就诊。而外生殖器呈女性表现,多数因腹股沟或阴唇异常包块、青春期年龄无月经来潮或身材矮小等较为隐匿及迟发的临床表现就诊,在此情况下,往往会在青春期后才确诊DSD。因此,患者就诊时间与其外生殖器异常程度有关,外生殖器异常越突出,就诊年龄越早。
本研究发现在416例患者中性染色体异常DSD占22.1%,46,XY DSD占68.5%和46,XX DSD占9.4%。Fernandes 等[5]学者在45例DSD患者中发现46,XY DSD为最常见,占57.8%,其次是性染色体异常DSD占31.1%和46,XX DSD占11.1%。这与本研究的DSD分类所占比例趋势基本一致。Erdogan等[6]学者则报道在95例DSD患者中,性染色体异常DSD占27.3%,46,XY DSD占47.4%,46,XX DSD占25.3%。国内梁等[7]学者报道83例DSD患儿中,性染色体异常19例(22.9%),46,XY DSD 40例(48.2%)和46,XX DSD 24例(28.9%)。46,XX DSD比例明显多于本研究,分析原因可能是46,XX DSD临床表现隐匿,相当一部分患者可能成年期才发现异常,并就诊于成人科室。由此可见,无论国内还是国外,46,XY DSD所占比例最多,性染色体核型异常者约占DSD 30%。
国内李翠等[8]学者报道性染色体异常DSD患者中,核型以克氏综合征所占比例最多,占比59%,45,X/46,XY仅占比0.8%。国外研究报道在1232例DSD患者中,核型结果显示性染色体异常占24.2%;其中Turner综合征最为常见(38.2%),其次是克氏综合征(24.9%)[9]。但本研究发现嵌合体45,X/46,XY 58例,为最多见,占63.0%(58/92)。此差异的原因可能与疾病表型和年龄关联,本研究就诊患者以男性外生殖器发育不良为主,且大多数患者年龄在青春期前。在性染色体异常DSD中,国外报道混合性性腺发育不全的病例达78.57%[6],而本研究92例患者中行性腺活检69例,病理为卵睾13例,占18.8%(13/69),考虑本研究性腺活检病例较少,后续将进一步扩大样本量。国内邓姗等[10]学者发现XO/XY性腺发育不全恶变率为60%,而Turner综合征SRY(+)则高达100%。本研究性染色体异常DSD患者行性腺病理活检69例,发现性腺恶变5例,占7.2%。因此,建议对核型为含Y染色体嵌合体的DSD患者应尽早进行性腺病理活检,定期随访,及时发现性腺恶变。此外,本研究还发现如果无法从性染色体核型解释性染色体异常DSD患者的临床表型和/或性腺活检结果时,应从分子遗传层面寻找DSD相关疾病基因,建议性染色体异常DSD患者结合临床表型进行DSD相关疾病基因变异检测,从多角度多层面精准分析诊断。
本研究发现46,XY DSD患者以男性抚养居多,就诊主诉以阴茎短小合并尿道下裂常见,155例(71.8%)是常染色体微异常或基因致病变异所致,其中SRD5A2基因变异47例(30.3%),AR基因变异38例(24.5%),NR5A1基因变异13例(8.4%),双基因变异2例(1.3%)。而国外学者则均报道AR基因较SRD5A2基因更为常见[6,11],提示DSD相关的致病基因变异频率可能存在种族差异。本研究结果显示46,XY DSD患者临床特征以阴茎短小合并尿道下裂常见,但致病基因复杂多样,大多数为罕见单基因病,表明临床医师切不可单纯凭借染色体核型而行尿道下裂修补术等手术治疗,需要行分子遗传学层面的病因检查,必要时性腺病理活检,再决定社会性别选择和手术方式。本研究还发现在按女性性别抚养的46,XY DSD患者中,检出双基因变异,所以按女性性别抚养患者不建议单一基因检测,可行DSD基因包检查或全外显子组测序以降低漏诊率和误诊率,警惕常见症状体征中隐藏的罕见病。
本研究发现26例性腺活检的46,XX DSD患者中24例(92.3%)存在睾丸组织,检测出的相关致病基因变异包括NR5A1基因、SOX3基因和SRY基因,提示这些基因变异与46,XX核型性腺反转有相当大的关联性;但仍有相当一部分XX核型性腺反转患者进行全外显子组测序结果未能明确致病基因,有待发现新变异或基因。国外学者报道在SRY阴性46,XX睾丸或卵睾DSD性腺样本中,发现68.7%恶变[12],但本研究46,XX核型患者性腺活检中未发现恶变情况,但仍强调46,XX DSD患者性腺病理活检必要性,需要定期追踪随访。
来自加拿大、新西兰、澳大利亚等12个国家DSD患者队列中,在46,XY DSD队列,发现57%的临床相关DSD基因存在变异;在46,XX DSD患者中,有18.8%存在DSD基因变异[13]。本研究在46,XY DSD队列中,发现71.8%的DSD患者存在常染色体微异常或基因致病变异;在46,XX DSD患者中,有52.0%存在DSD基因变异。可见目前国内外DSD患者大多数均可在分子遗传学上找到病因。作为DSD诊疗团队成员,应积极给予患者完善染色体和DSD相关基因检测,明确DSD病因,为给予规范的个性化诊疗方案提供充分的依据。
综上所述,DSD患者临床表现异质性大,可以表现为尿道下裂、小阴茎、隐睾等泌尿系统症状体征,病因复杂,不同病因的治疗抉择不同。因此,疾病分子水平精准识别诊断十分重要,可以通过染色体核型、分子遗传学检测及性腺病理等检查明确病因,提高检出率减少漏诊率,确保合理治疗,尤其是性别选择。
作者贡献:论文选题与设计:刘丽、刘国昌、程静;撰稿:林婉珺、梁翠丽、刘丽;临床病例资料提供:刘丽、刘国昌、程静、张文、梁翠丽、伏雯、张丽瑜、贾炜、胡金华;检验与分析:林云婷、牛会林、范莉萍、卢致琨、李端、刘宗才、盛慧英、尹曦、陈晓丹、梁翠丽、刘丽。
利益冲突:所有作者均声明不存在利益冲突。
参考文献
[1]Li Y, Mao M, Dai L, et al. Time trends and geographic variations in the prevalence of hypospadias in China[J]. Birth Defects Res A Clin Mol Teratol,2012,94(1):36-41.
[2]刘贵中,白文俊.小阴茎规范性诊疗进展[J].中华男科学杂志,2022,28(3):247-251.
[3]Hughes IA,Houk C,Ahmed SF,et al.Consensus statement on management of intersex disorders[J]. J Pediatr Urol,2006,2(3):148-162.
[4]Eggers S,Ohnesorg T,Sinclair A. Genetic regulation of mammalian gonad development[J].Nat Rev Endocrinol,2014,10(11):673-683.
[5]Fernandes G,Mhashete P,Desale M. Disorders of sexual development-pathological profile of 45 cases at a tertiary care centre[J]. J Clin Diagn Res,2022,16(3):ER07-ER13.
[6]Erdogan S,Kara C,Uaktürk A,et al.Etiological classification and clinical assessment of children and adolescents with disorders of sex development[J].J Clin Res Pediatr Endocrinol,2011,3(2):77-83.
[7]梁,吕逸清,谢华,等.83例性发育异常患儿的性腺探查结果分析[J].临床泌尿外科杂志,2020,35(1):17-20,25.
[8]李翠,王晓岩,赵明刚,等.性染色体型性发育异常的遗传学分析及临床意义[J].中国妇幼健康研究,2022,33(3):100-104.
[9]Al-Alawi I,Goud TM,Al-Harasi S,et al. Cytogenetic studies of 1232 patients with different sexual development abnormalities from the Sultanate of Oman[J]. Reprod Biomed Online,2016,32(2):162-169.
[10]邓姗,田秦杰.性发育异常的诊治要点及现状[J].中国计划生育和妇产科,2020,12(3):23-30.
[11]Shamma RA,Atef S,Arafa N. Etiological classification and clinical spectrum of Egyptian pediatric patients with disorder of sex development,single center experience[J]. Endokrynol Pol,2021,72(5):558-565.
[12]Costanzo M,Touzon MS,Marino R,et al. Gonadal tumor development in 46,XX disorders of gonadal development[J]. Eur J Endocrinol,2022,187(3):451-462.
[13]Eggers S,Sadedin S,van den Bergen JA,et al. Disorders of sex development:insights from targeted gene sequencing of a large international patient cohort[J]. Genome Biol,2016,17(1):243.


