论著|基于《第二批罕见病目录》的罕见病药物目录和药物可及性研究
中国罕见病联盟
目的 本研究将梳理《第二批罕见病目录》的罕见病药物,为罕见病药物治疗的管理提供参考。方法 基于中国《第二批罕见病目录》,以中国药品说明书、美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)批准用于治疗上述疾病的药物为标准,梳理形成中国第二批罕见病药物目录,并对药物的可及性、国产化情况及国家医保目录覆盖情况等进行分析。结果 截至2023年12月31日,从疾病角度分析,《第二批罕见病目录》共37种疾病在国内有说明书适应证批准的药物,另有10种疾病有美国FDA或EMA上市并在国内获得批准文号的药物,但在国内为超说明书用药。从药物角度分析,国内有55种药物的说明书适应证批准用于治疗《第二批罕见病目录》疾病,另有22种药物在美国FDA或EMA上市并在国内获得批准文号,但在国内为超说明书用药。上述国内已获批罕见病适应证或已获得批准文号的药物,39种药物至少1种剂型有国产批准文号,覆盖30种罕见病;37种药物用于至少1种罕见病纳入国家医保目录并在报销范围内,覆盖29种罕见病。结论 本研究总结了《第二批罕见病目录》的罕见病药物。中国上市的罕见病药物数量及罕见病药物覆盖的疾病种类快速增加,罕见病药物国产化比例及纳入医保目录报销的比例不断提高。
2018年5月和2023年9月,中国先后发布了第一批[1]、第二批罕见病目录[2],首次以目录的形式确定了国内罕见病的定义和范围,对于罕见病治疗药物的可及性与可获得性、新药和仿制药的研发,医保目录的调整等均起到了推动作用。然而,相较于美国食品药品监督管理局(Food and Drug Administration,FDA)和欧洲药品管理局(European Medicines Agency, EMA)对于孤儿药的定义,目前国内仍缺少对于罕见病治疗药物的定义。
国内缺乏罕见病药物目录造成了诸多挑战。一方面,在开展公立医院绩效考核等药事管理工作中,缺乏统一的标准;在分析罕见病药物治疗可及性与可获得性时,不同机构统计与报道的罕见病药物数据存在较大差异[3-6]。另一方面,相较于国外对于孤儿药的市场独占期与加速途径等政策,制定罕见病药物目录可进一步推动罕见病药物的研发,同时有助于医疗人员和公众及时获得罕见病药物治疗的新进展。
国内罕见病药物上市品种数与可覆盖罕见病数不断提高,越来越多的罕见病药物通过“国谈”等方式纳入医保目录,仍然存在“国外有药物,国内无相关药物(或剂型)”“国内有药物,但难于获得”“国内可获得,但难以负担”等现象[7]。2024年的第十四届全国人民代表大会第二次会议《政府工作报告》中再次提出了“加强罕见病研究、诊疗服务和用药保障”,对罕见病药物目录进行梳理,并对可及性、可获得性进行分析具有重要意义。
1 资料与方法
1.1 一般资料
研究对象为《第二批罕见病目录》的罕见病药物,研究纳入满足以下2个条件之一的药物:①截至2023年12月31日,国内药品说明书适应证批准用于《第二批罕见病目录》疾病的药物;②截至2023年12月31日,国外(美国FDA或EMA)批准用于《第二批罕见病目录》疾病,并在中国国家药品监督管理局(National Medical Products Administration,NMPA)获得批准文号,但中国药品说明书未批准用于上述疾病的药物,见图1。
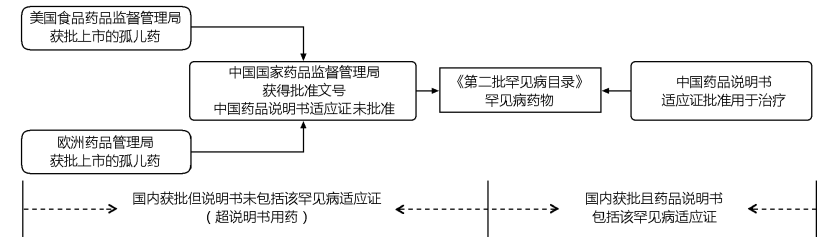
图 1本研究中《第二批罕见病目录》罕见病药物纳入标准
Fig.1The inclusion criteria of rare disease drugs in the China′s Second List of Rare Diseases
数据检索截至2023年12月31日
1.2 方法
梳理《第二批罕见病目录》86种疾病在国内外的治疗现状及罕见病药物目录。国内,因目前尚无罕见病药物的目录或数据库,故通过“药智网”“用药助手”等工具,检索罕见病在药品说明书的批准情况及药品说明书适应证批准用于罕见病的药物,检索时间截至2023年12月31日。国外,检索罕见病在美国FDA孤儿药数据库[8]和EMA药品数据库[9]的罕见病药物批准上市情况及批准上市的罕见病药物(孤儿药),检索时间范围自数据库建立至2023年12月31日。并提取上述药物在中国NMPA(截至2023年12月31日)[10]获得批准文号品种,以及所用于治疗的罕见病,中国药品说明书是否批准用于该罕见病。
从疾病角度和药物角度对国内外罕见病药物的可及性进行分析。从疾病角度分析,可得到药物可用于治疗的疾病种类,体现对于罕见病诊疗能力;从药物角度分析,可得到用于罕见病治疗的药物种类,体现罕见病药物上市数目和说明书批准数目等的变化趋势。分别统计《第二批罕见病目录》在国内、美国FDA和EMA已上市药物数目和药物覆盖疾病数目、美国FDA和EMA上市药物在国内超说明书适应证的药物数目和覆盖疾病数目。随后,进一步分析国内罕见病药物的国产化情况和医保覆盖情况。对于 NMPA 已有批准文号的罕见病药物,记录其国产和/或进口药品文号情况,分析罕见病药物在中国国产化情况;通过 2024年1月1日实施的国家基本医疗保险目录(2023年版)[11],检索具有 NMPA批准文号的罕见病药物是否纳入国家医保目录报销范围,分析罕见病药物在中国的医保覆盖情况。此外,通过药品说明书,NMPA药品审评中心网站公布的优先审评药物名单、三批次临床急需境外新药名单[12-14],以及国家卫生健康委员会公布的三批次鼓励仿制药品目录[15-17],检索上述药物是否纳入“附条件上市程序”“优先审评程序”,以及是否具有“临床急需境外新药”和“鼓励仿制药品”的身份,分析国内在鼓励罕见病药物研发和审评等政策方面的变化。
信息检索、梳理和统计分析工作均由双人核对完成,以确保数据准确。
1.3 统计学分析
本研究采用描述性统计学方法,通过频数(构成比)对罕见病病种数、罕见病药物种数等计量资料进行统计描述。
2 结果
2.1 罕见病治疗现状分析
从疾病角度分析,《第二批罕见病目录》在国内共37种疾病有药品说明书批准用于治疗。在美国,56种疾病有药物批准上市[8],其中42种疾病的药物在中国获得批准文号[10],占比75.0%。另外,有10种罕见病有美国FDA或EMA批准上市的药物尽管在中国NMPA获得批准文号,但为超说明书适应证用药。
因此,国内合计共47种罕见病有药物进行治疗(包含国内说明书适应证批准37种和超说明书用药10种),详见表1~2。
2.2 罕见病药物目录梳理
从药物角度分析,在国内有55种药物的说明书适应证批准用于《第二批罕见病目录》的疾病(36种药物纳入优先审评审批程序,9种药物为附条件批准上市)。在美国,115种药物批准上市[8],其中57种在中国NMPA获得批准文号[10],占比49.6%。另外,有22种美国FDA或EMA批准上市的药物在中国获得批准文号,但为超说明书用药,其中14种药物用于罕见病均为超说明书适应证用药,8种药物用于部分罕见病为超说明书适应证用药。
因此,国内合计共有69种罕见病药物(包含国内说明书适应证批准55种和超说明书用药14种),详见表1~2。

表 1 国内药品说明书适应证批准治疗《第二批罕见病目录》的药物
Tab.1Drugs approved by domestic indications for the China′s Second List of Rare Diseases
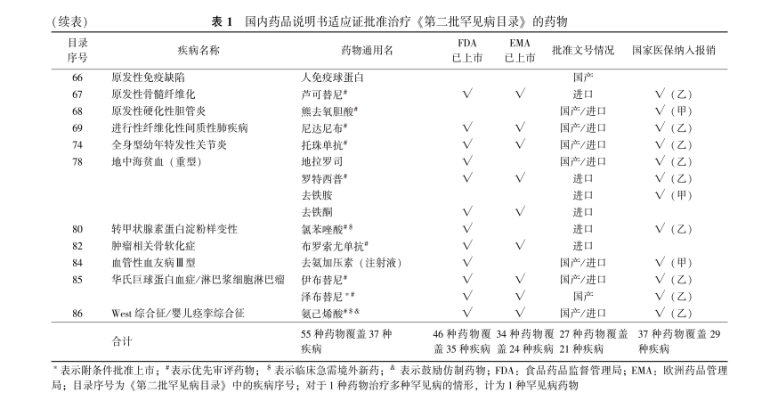
(续表)表 1国内药品说明书适应证批准治疗《第二批罕见病目录》的药物
表 2美国FDA/EMA批准但国内说明书适应证未批准治疗《第二批罕见病目录》的药物
Tab.2Drugs approved by U.S. FDA/EMA but not approved by the domestic indications for the China′s Second List of Rare Diseases
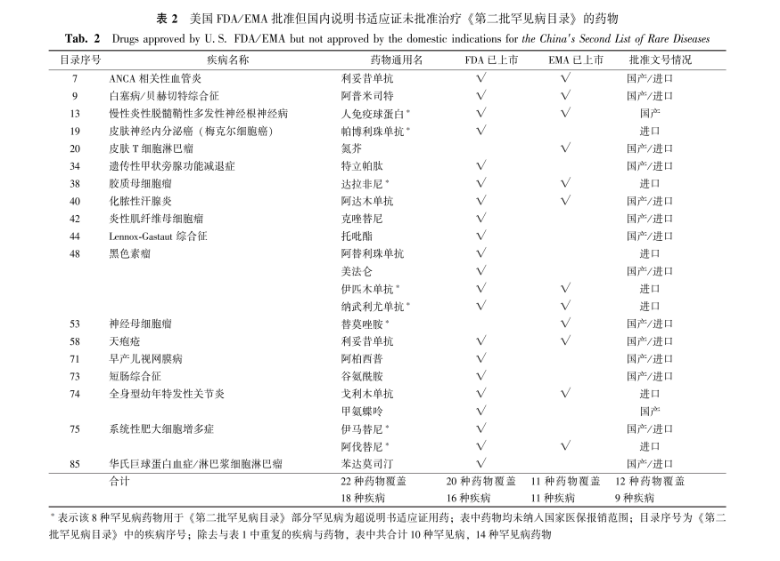
2.3 罕见病药物可及性分析
对《第二批罕见病目录》国内说明书已获批,以及美国FDA或EMA已上市并在中国获得批准文号药物的批准文号进行分析。39种(56.5%, 39/69)药物的至少1种剂型有国产批准文号,其中,说明书批准用于罕见病的药物27种(49.1%, 27/55)有国产批准文号,覆盖21种罕见病(表1);超说明书用药的药物有12种(85.7%,12/14)有国产批准文号,覆盖9种罕见病(表2)。值得关注的是,索凡替尼、纳鲁索拜单抗、特瑞普利单抗、聚乙二醇重组人生长激素、泽布替尼等罕见病药物为中国自主研发的Ⅰ类新药;氯巴占、丹曲林纳、莫达非尼等为国内首仿的罕见病药物。
对上述药物在国家医保目录纳入和报销覆盖情况进行分析,37种(53.6%, 37/69)药物用于《第二批罕见病目录》的至少1种疾病纳入国家医保目录并在报销范围内,均为国内药品说明书适应证批准用于罕见病的药物,覆盖29种罕见病(表1)。2018年起,国家医保目录每年均进行更新,截至2024年1月,已有23种用于《第二批罕见病目录》的药物新增进入国家医保目录,见表3。
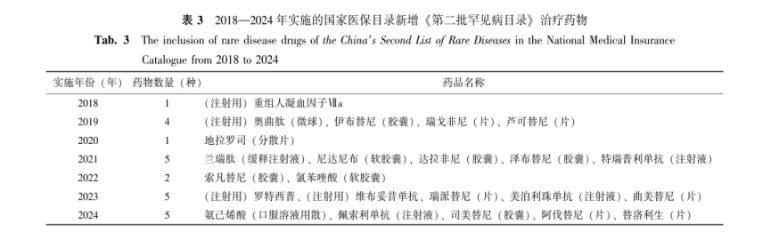
表 3 2018—2024年实施的国家医保目录新增《第二批罕见病目录》治疗药物
Tab.3The inclusion of rare disease drugs of the China′s Second List of Rare Diseases in the National Medical Insurance Catalogue from 2018 to 2024
3 讨论
3.1 罕见病药物加速批准
罕见病目录促进了境外新药在国内的上市,缩小了国内与美国、欧盟等罕见病药物上市品种数和药物覆盖疾病种类的差距[18]。近年来,国家通过一系列政策保障罕见病的药物治疗,例如罕见病药物优先审评程序和附条件上市程序等。《第二批罕见病目录》36种罕见病药物纳入了优先审评审批程序、9种罕见病药物纳入附条件上市程序。
国家先后发布了3个批次临床急需境外新药,其中氯苯唑酸、塞奈吉明和氨己烯酸3种药物为《第二批罕见病目录》拥有该身份的罕见病药物;用于冷吡啉(冷炎素)相关周期性综合征的canakinumab和rilonacept,用于晚发婴儿型神经元蜡样脂褐质沉积症的cerliponase alfa也是《第二批罕见病目录》疾病中拥有此身份的药物,未来有望获批上市。
3.2 罕见病药物本土研发与仿制
罕见病目录促进了国内企业新药和仿制药品的研发。针对《第二批罕见病目录》的5种罕见病药物为国产创新药、3种罕见病药物为国内首仿药上市,标志着中国药品企业研发技术水平的提高。国家先后发布了三批次鼓励仿制药品目录,用于West综合征的氨己烯酸和用于Lennox-Gastaut综合征的氯巴占均在此目录中,并已取得国产批准文号,未来还将有更多罕见病药物实现国内生产。
此外,目前还有多种在研药物用于治疗《第二批罕见病目录》疾病,如艾加莫德α用于天疱疮和慢性炎性脱髓鞘性多发性神经根神经病、乌帕替尼用于大动脉炎、佩索利单抗用于化脓性汗腺炎、氯马昔巴特用于先天性胆道闭锁等[19],未来也将有机会用于罕见病患者。
3.3 罕见病药物医保目录覆盖
罕见病目录的发布对于罕见病药物进入医保也起到了促进作用。近年来,新进入医保目录的药物数目快速增加。当前,半数以上罕见病的药物治疗已得到了医保保障,具有多种治疗药物的疾病还有部分药物未纳入医保,医保覆盖疾病的比例和纳入医保药物的比例仍有提升的空间。
此外,利妥昔单抗、阿达木单抗、氮芥、克唑替尼、阿普米司特、阿柏西普、戈利木单抗尽管在医保目录内,但用于《第二批罕见病目录》疾病为超说明书用药,不属于医保报销范围。对于国外上市而国内超说明书适应证的药物,应推动临床研究的开展,并及时修订药品说明书,以促进这部分药物用于罕见病的可支付性。
研究还存在以下局限性。在分析罕见病药物可及性方面,仅从药品的批准文号和医保目录准入等理论层面进行了统计,未来还需进一步结合医疗机构实际配备等角度对可及性进行调研。
本研究梳理了《第二批罕见病目录》的罕见病药物目录,并对罕见病药物在国内外批准上市情况、超说明书用药情况、国产化情况和医保目录覆盖情况等可及性进行了分析。中国与国外批准上市的罕见病药物和覆盖疾病数的差距缩小,国产化和纳入医保目录报销的罕见病药物和覆盖疾病数持续增加。
作者贡献:刘清扬负责罕见病信息检索和论文撰写;刘鑫、左玮、王少红负责数据核对;张波、张抒扬负责论文最终审校。
利益冲突:所有作者均声明不存在利益冲突。
参考文献
[1]国家卫生健康委员会, 科学技术部, 工业和信息化部, 等. 关于公布第一批罕见病目录的通知(国卫医发〔2018〕10号)[EB/OL]. (2018-05-11)[2023-11-10]. http://www.
nhc.gov.cn/yzygj/s7659/201806/393a9a37f39c4b458d6e 830f40a4bb99.shtml.
[2]国家卫生健康委员会, 科学技术部, 工业和信息化部, 等. 关于公布第二批罕见病目录的通知(国卫医政发〔2023〕26号)[EB/OL]. (2023-09-18)[2023-11-10]. http://www.
nhc.gov.cn/yzygj/s7659/202309/19941f5eb0994615b34273 bc27bf360d.shtml.
[3]2021年中国罕见病大会. 破解用药难 国家医保药品目录已纳入40余种罕见病用药[EB/OL]. (2021-12-18)[2023-11-10]. https://www.gov.cn/xinwen/2021-12/18/content_5661803.htm.
[4]黄如方, 邵文斌. 中国罕见病药物可及性报告(2019)[M].北京: 罕见病发展中心出版, 2019:13.
[5]徐陆欣怡,王妮,尹适成,等.我国罕见病药品的可及性及采购使用现状研究[J].中国卫生政策研究,2022,15(2):60-64.
[6]中华人民共和国中央人民政府.国家医保局:已有50余种罕见病用药纳入医保药品目录[EB/OL]. (2023-08-22)[2023-11-10]. https://www.gov.cn/govweb/lian-bo/bumen/202308/content_6899489.htm.
[7]刘清扬,刘鑫,王少红,等. 基于《第一批罕见病目录》的罕见病药物可及性研究[J]. 协和医学杂志,2023,14(6):1208-1216.
[8]U.S. Food and Drug Administation. Search orphan drug designations and approvals[EB/OL]. (2023-11-10)[2023-11-10].https://www.accessdata.fda.gov/scripts/opdlisting/oopd/index.cfm.
[9]European Medicines Agency. Medicine-related information[EB/OL]. (2022-12-31)[2022-12-31].https://www.ema.europa.eu/en/medicines.
[10]国家药品监督管理局.数据查询[EB/OL]. (2022-12-31)[2022-12-31]. https://www.nmpa.gov.cn/datasearch/home-index.html#category=yp.
[11]国家医保局, 人力资源社会保障部. 关于印发《国家基本医疗保险、工伤保险和生育保险药品目录(2023年)》的通知(医保发〔2023〕30号)[EB/OL]. (2023-12-07)[2023-12-26]. http://www.nhsa.gov.cn/art/2023/12/13/art_53_11674.html.
[12]国家药品监督管理局药品审评中心. 关于发布第一批临床急需境外新药名单的通知[EB/OL]. (2018-11-01)[2023-11-10].https://www.cde.org.cn/main/news/view-InfoCommon/21de8acd6c395746b041b2ad93eb5c43.
[13]国家药品监督管理局药品审评中心. 关于发布第二批临床急需境外新药名单的通知[EB/OL]. (2019-05-29)[2023-11-10].https://www.cde.org.cn/main/news/view-InfoCommon/82f3bf94dc2c38d1a24d851f0e44914b.
[14]国家药品监督管理局药品审评中心. 关于发布第三批临床急需境外新药名单的通知[EB/OL]. (2020-11-19)[2023-11-10]. https://www.cde.org.cn/main/news/view-InfoCommon/08818b168ccc85db9a42a0f6623b5688.
[15]国家卫生健康委办公厅, 科技部办公厅, 工业和信息化部办公厅, 等. 关于印发第一批鼓励仿制药品目录的通知(国卫办药政函〔2019〕744号)[EB/OL]. (2019-09-17)[2023-11-10]. http://www.nhc.gov.cn/yaozs/
s7656/201910/38e3961482c04b59a2aa3e36106b1a4f.shtml.
[16]国家卫生健康委办公厅, 科技部办公厅, 工业和信息化部办公厅, 等. 关于印发第二批鼓励仿制药品目录的通知(国卫办药政函〔2021〕93号)[EB/OL]. (2021-02-20)[2023-11-10]. http://www.nhc.gov.cn/yaozs/s7656/202103/78ab1ead0b51420a85024 ea01a45354c.shtml.
[17]国家卫生健康委办公厅, 工业和信息化部办公厅, 国家知识产权局办公室,等. 关于印发第三批鼓励仿制药品目录的通知(国卫办药政函〔2023〕471号)[EB/OL]. (2023-12-20)[2023-12-26]. http://www.nhc.gov.cn/yaozs/s7656/202312/b6617e087d9a424fa2ef844c00c7cf43.shtml.
[18]刘鑫,李建涛,张鹏霄,等. 中国孤儿药现状及与国外对比分析研究[J]. 中国药学杂志,2019,54(10):839-846.
[19]李柯欣,赵琨,郑佳音,等. 《第二批罕见病目录》收录病种的药物研发和落地现状[J]. 罕见病研究,2023,2(4):596-601.


