病例报告 | 维莫非尼联合利妥昔单抗成功治疗复发性毛细胞白血病1例
中国罕见病联盟
毛细胞白血病(HCL)是一种在临床上较为罕见的血液系统恶性肿瘤。本文报道了1例复发性HCL患者的诊疗过程。患者为51岁女性,于2013年6月确诊为HCL,并接受克拉屈滨单药化疗,化疗后评估疗效为部分缓解。2023年11月出现胸闷、憋气,超声示右侧胸腔积液。2024年2月复查示HCL复发,予维莫非尼联合利妥昔单抗治疗,迅速达到完全缓解并不伴微小残留病。本病例可为复发性HCL的治疗提供参考。
毛细胞白血病(hairy cell leukemia,HCL)是一种罕见的血液系统肿瘤,该疾病在欧美国家的年发病率约为2.9/100万人,而亚洲人群发病率显著更低[1]。患者主要临床表现包括出血、乏力、反复感染等,在骨髓、外周血、脾脏中可见“毛细胞”浸润,BRAFV600E突变是该疾病的标志性分子遗传学异常。目前一线治疗方案是以克拉屈滨为代表的嘌呤类似物。近年来,新型药物BRAF抑制剂也逐渐被应用于HCL的治疗中,但其在中国临床实践中的应用仍较为有限,尚缺乏相关病例报告及临床研究数据。本文报道一例利用维莫非尼联合利妥昔单抗成功治疗复发性HCL的病例,为该方案在中国HCL患者中的应用提供循证医学证据,有助于临床医师更深入了解及应对该类疾病。
1临床资料
患者,女,51岁,因“月经增多、肝脾大9年,颈部淋巴结肿大8月”于2013年6月首次就诊于北京协和医院(以下简称“我院”)。患者2年内体重下降7 kg。查体:贫血貌,左侧颈后可触及一枚直径约1.5 cm淋巴结,质中,活动度好,脾肋缘下9 cm,轻压痛。血常规:白细胞计数(WBC)1.31×109/L,血红蛋白(HGB)78 g/L,血小板计数(PLT)64×109/L;血涂片:未见异常形态白细胞;骨髓涂片:毛细胞50.5%,粒系少见,红系、淋巴系及单核细胞比例形态正常,全片巨核细胞9个,均为颗粒巨核细胞,血小板少见,结合临床怀疑HCL。进一步完善检查:BRAF基因第15外显子V600E(1799T>A)突变(+),为致病性变异,美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)分类依据为PS1+PS2+PS4+PM1_中等+PM2_中等+PM5_中等+PP2_辅助证据+PP3_辅助证据;骨髓免疫分型可见部分异常表型B细胞,CD11c(+)、CD25(+)、CD103(+)、CD22(+)、CD19(+)、CD20(+)、cKappa(+);骨髓活检:骨髓组织中见较多小淋巴细胞样细胞浸润,免疫组化显示主要为B淋巴细胞:CD15(-)、CD20弥漫(+)、CD3散在少许(+)、MPO(-)。综上确诊为HCL。2013年6月起予克拉屈滨单药治疗,具体方案为:克拉屈滨8 mg/d,共5 d。用药后曾有粒细胞缺乏伴发热,肺部感染,支持及抗感染治疗后好转。2013年11月复查血常规:WBC 4.51×109/L,HGB 115 g/L,PLT 205×109/L;血涂片:未见异常形态白细胞;骨髓涂片:可见毛细胞,占1%;骨髓活检:大致正常,少量纤维组织,巨核易见;肝胆胰脾超声:肝剑下1.5 cm,肋下(-),脾肋下(-); 评估疗效为部分缓解(partial remission,PR)[2]。之后规律于我院门诊复查血常规、血涂片均未见明显异常。2016年12月复查血常规示血两系降低:WBC 2.64×109/L,HGB 129 g/L,PLT 76×109/L,但患者因无症状未进一步诊疗,此后未规律随诊。2023年11月起,患者出现胸闷、憋气,超声提示右侧胸腔积液,外院考虑“右侧结核性胸膜炎可能性大”,予“经验性抗结核”治疗1个月后因上述症状无明显缓解,停抗结核药。2024年2月再次就诊我院,考虑“HCL复发可能”。既往于2007年感染布鲁氏菌,现已治愈,个人史、家族史无殊。
体格检查:神清语利,双侧颈部、腹股沟可触及多个直径<1 cm的淋巴结,质中,无压痛,活动度好,脾肋下3指。
辅助检查:①血清学检查。血常规:WBC 3.82×109/L,HGB 129 g/L,PLT 71×109/L;肝肾功、凝血功能大致正常;②骨髓检查。骨髓涂片:可见少许毛细胞;活检:造血组织中淋巴细胞比例增高;免疫组化:CD3(散在+)、CD20(部分+)、CD38(部分+)、CD117(-)、PAX-5(部分+);骨髓免疫分型:可见部分异常表型B细胞,占淋巴细胞的25%,CD25(+)、CD103(+)、CD11c(弱+)、CD5(-)、CD10(-)(图1);③胸腔积液免疫分型。可见30.08%单克隆异常表型B细胞,CD19(+)、CD20(+)、CD11c(+)、CD25(+)、CD103(+)、CD200(+)、cKappa(+)、CD5(-)、CD10(-),符合HCL;④影像学检查。胸腔积液超声:双侧胸腔积液;肝胆胰脾超声:脾大,脾厚5.1 cm,长径19.2 cm,肋下8.1 cm;腹盆CT平扫:肝脾体积增大,脾脏尤著。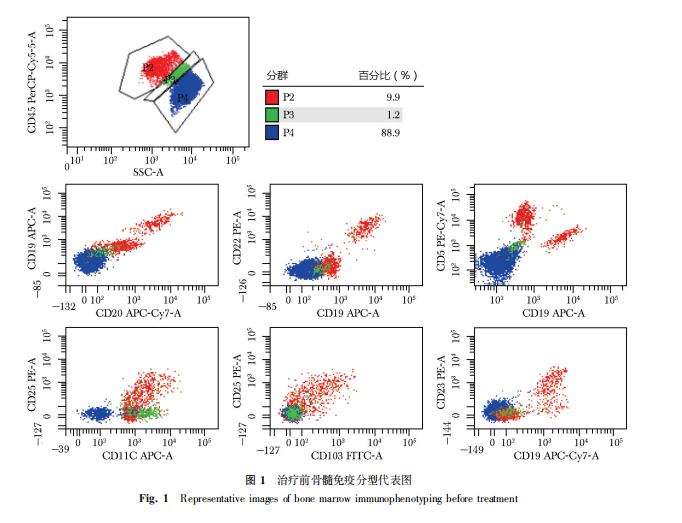
治疗与预后:结合患者临床表现、体格检查与辅助检查结果,考虑患者HCL复发诊断明确。2024年2月起行维莫非尼+利妥昔单抗治疗,具体为:维莫非尼480 mg,2次/日,共8周,联合利妥昔单抗375 mg/m2,每2周1次,共8次[3]。用药期间,患者未出现包括骨髓抑制、皮疹、心律失常在内的明显不良反应。完成8周维莫非尼及4次利妥昔单抗治疗后,于2024年4月复查血常规:WBC 5.13×109/L,HGB 132 g/L,PLT 193×109/L;外周血涂片及骨髓涂片:未见毛细胞;骨髓活检:大致正常,免疫组化:CD3(散在+)、CD20(-)、CD38(部分+)、CD117(散在+)、PAX-5(散在+);骨髓免疫分型:未见异常表型细胞,达到微小残留病(minimal residual disease,MRD)阴性(图2);骨髓BRAF突变转阴;胸腔积液超声:胸腔积液明显减少,难以定位;腹盆CT平扫:脾脏较前缩小。体格检查未及肝脾大。目前患者已完成上述治疗方案,疗效为完全缓解(complete remission,CR)不伴MRD[2]。患者仍接受定期随访中。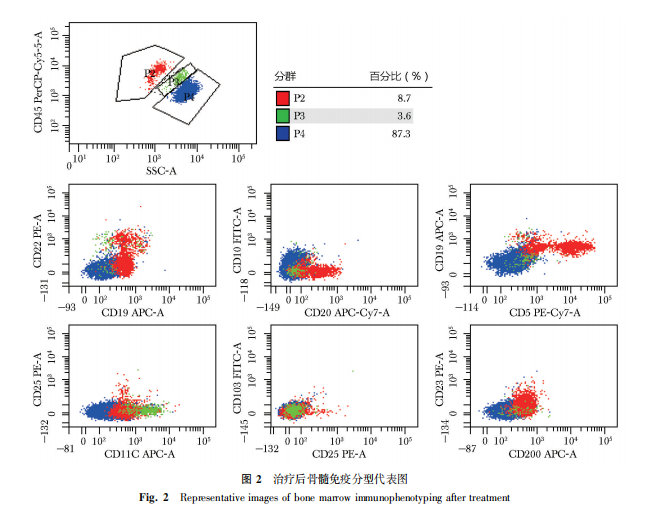
2讨论
HCL是一种以B细胞慢性淋巴样细胞增殖紊乱为特点的少见的白血病类型,约占所有白血病病例的2%[4]。患者通常表现为全血细胞减少与肝脾大,但不伴有淋巴结肿大。外周血涂片及骨髓涂片常可见“毛细胞”,典型的免疫表型为CD19、CD20、CD11c、CD25、CD103、CD123(+),CD5、CD10(-)。绝大多数患者存在BRAFV600E突变。该疾病的病程相对慢性,仅有达到治疗指征的患者需要立即开始治疗。疗效评估指标包括血液学评估(血三系水平)、形态学评估(外周血及骨髓涂片)及症状评估(脾大)。对于获得CR的患者,应用骨髓免疫分型或免疫组织化学评估MRD[2]。
以克拉屈滨为代表的嘌呤类似物是初治HCL的一线治疗方案。多数患者接受一线治疗后均可达到CR,且与利妥昔单抗联用可进一步提高MRD阴性率[5-6]。然而,克拉屈滨的骨髓抑制作用显著,接受该治疗的患者常出现严重的中性粒细胞减少、缺乏所致的发热、感染、血小板减少等不良反应。并且,多数患者在接受一线治疗后会出现复发,且复发后的患者对嘌呤类似物的反应显著下降,导致预后较差。
BRAFV600E是HCL的标志性遗传学异常。该突变可使RAF不受上游RAS的调控,持续发挥磷酸激酶作用,异常激活RAS-RAF-MEK-ERK信号通路,导致细胞过度增殖。以维莫非尼为代表的新型药物BRAF抑制剂也已被用于HCL的治疗中(表1)。与该药治疗许多其他疾病需要长期用药不同,现有研究使用有限疗程的维莫非尼治疗HCL,极大地提高了该药在HCL中的应用前景。2015年的一项Ⅱ期临床试验中,对两组复发/难治性HCL患者进行维莫非尼单药治疗。根据疗效评估结果,治疗周期设置在8~16周。其中一组患者的总体应答率(overall response rate, ORR)为96%,CR率为35%,中位无进展生存期(progression free survival, PFS)为19个月;另一组患者的ORR为100%,CR率为42%,1年随访的PFS率为73%[7]。进一步对该组患者进行中位数为40个月的长期临床随访发现,68%的患者经历了复发,中位无复发生存期(relapse free survival, RFS)为19个月。复发患者中67%重新接受了维莫非尼的治疗,其中86%患者达到了完全血液学缓解,中位RFS为12.7个月。用药期间仅发生2例Ⅲ级以上不良反应,患者的总体生存率(overall survival, OS)为82%[8]。另一项Ⅱ期临床试验报道维莫非尼联合利妥昔单抗治疗可进一步提高ORR及PFS,该研究中维莫非尼共应用8周,利妥昔单抗共使用8次,用药后87%患者达CR,65%患者MRD阴性,37个月随访的PFS率达78%[3]。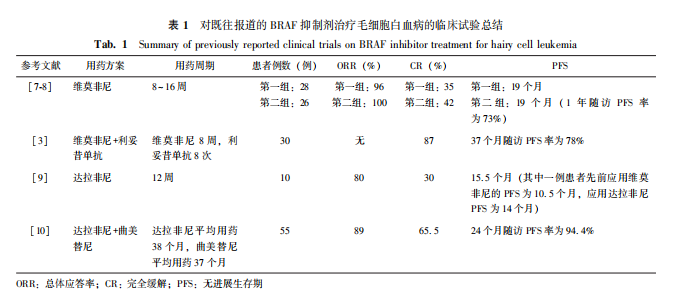
与维莫非尼类似,达拉非尼也是一种BRAF抑制剂,目前较常应用于转移性黑色素瘤的治疗中。近年来,越来越多研究也探索了该药物在HCL中的安全性和有效性。2021年,Tiacci等[9]报道了使用标准剂量(150 mg,每日2次,共12周)的达拉非尼单药治疗复发/难治性HCL的临床获益与维莫非尼单药治疗相当,且具有更长的PFS。HCL细胞可通过获得性RAS突变及NF1/NF2缺失等机制重新激活MAPK通路,从而导致其对BRAF抑制剂耐药。因此,联合抑制MAPK通路可进一步改善HCL患者的临床结局。2023年,Blood发表了达拉非尼联合曲美替尼治疗复发/难治性HCL的前瞻性临床研究结果:接受治疗的55例患者中ORR可达89%,24个月的PFS率为94.4%,且安全性良好[10]。
与克拉屈滨相比,BRAF抑制剂的副反应更温和,不仅无明显的骨髓抑制,还可通过增加外周血白细胞数量协助控制感染[11]。因此,该药物也可用于伴有严重感染或无法耐受嘌呤类似物治疗的HCL患者。然而,BRAF抑制剂也可能引发包括心律失常、QT间期延长、皮肤角化过度和新发皮肤肿瘤等潜在副反应。因此,在用药前后应定期进行心电图复查和皮肤相关检查。其他治疗方案还包括干扰素-α、脾切除,但疗效和安全性都很难与前述方案(嘌呤类似物、BRAF抑制剂、利妥昔单抗)相比,因此这些方案目前在临床上应用相对较少。
本例患者初诊HCL时接受1疗程克拉屈滨化疗后达到PR,高度可疑3年后复发,并于2023年确认复发。考虑患者既往应用克拉屈滨治疗时骨髓抑制作用严重,并结合患者意愿,选用维莫非尼+利妥昔单抗方案治疗。用药后患者血三系迅速恢复至正常水平,骨髓涂片未见毛细胞,骨髓免疫分型未见异常表型细胞,体格检查未及脾大,评估疗效为CR并不伴有MRD。在治疗期间及随访过程中,患者未出现明显不良反应,至今未见疾病进展。本病例提示该方案在毛细胞白血病治疗中具有较好的临床应用前景。
作者贡献:秋昱翀负责病例分析、文稿撰写;李美姿负责病例采集与分析;张路负责病例采集与分析、研究设计、文稿撰写与修改;李剑负责研究设计、文稿修改。
利益冲突:所有作者均声明不存在利益冲突。
参考文献
[1]Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012[J]. Eur J Cancer, 2013, 49(6): 1374-1403.
[2]中国抗癌协会血液肿瘤专业委员会,中华医学会血液学分会,中国慢性淋巴增殖性疾病工作组. 毛细胞白血病诊断与治疗中国指南(2023年版)[J]. 中华血液学杂志,2023,44(12):969-976.
[3]Tiacci E, De Carolis L, Simonetti E, et al. Vemurafenib plus rituximab in refractory or relapsed hairy-cell leukemia[J]. N Engl J Med, 2021,384(19):1810-1823.
[4]Teras LR, DeSantis CE, Cerhan JR, et al. 2016 US lymphoid malignancy statistics by World Health Organization subtypes[J]. CA Cancer J Clin, 2016, 66(6): 443-459.
[5]Chihara D, Kantarjian H, O'Brien S, et al. Long-term durable remission by cladribine followed by rituximab in patients with hairy cell leukaemia: update of a phase Ⅱ trial[J]. Br J Haematol, 2016, 174(5): 760-766.
[6]Chihara D, Arons E, Stetler-Stevenson M, et al. Rando-mized phase Ⅱ study of first-line cladribine with concurrent or delayed rituximab in patients with hairy cell leukemia[J]. J Clin Oncol, 2020, 38(14): 1527-1538.
[7]Tiacci E, Park JH, De Carolis L, et al. Targeting mutant BRAF in relapsed or refractory hairy-cell leukemia[J]. N Engl J Med, 2015, 373(18): 1733-1747.
[8]Handa S, Lee JO, Derkach A, et al. Long-term outcomes in patients with relapsed or refractory hairy cell leukemia treated with vemurafenib monotherapy[J]. Blood, 2022, 140(25): 2663-2671.
[9]Tiacci E, De Carolis L, Simonetti E, et al. Safety and efficacy of the BRAF inhibitor dabrafenib in relapsed or refractory hairy cell leukemia: a pilot phase-2 clinical trial[J]. Leukemia, 2021, 35(11): 3314-3318.
[10]Kreitman RJ, Moreau P, Ravandi F, et al. Dabrafenib plus trametinib in patients with relapsed/refractory BRAF V600E mutation-positive hairy cell leukemia[J]. Blood, 2023, 141(9): 996-1006.
[11]Dietrich S, Zenz T. BRAF inhibitor therapy in HCL[J]. Best Pract Res Clin Haematol, 2015, 28(4): 246-252.


