指南与共识 | 阵发性睡眠性血红蛋白尿补体抑制剂治疗与管理专家共识
中国罕见病联盟
阵发性睡眠性血红蛋白尿(PNH)是一种罕见的造血干细胞克隆性疾病,由于基因突变导致糖基磷脂酰肌醇(GPI)锚连蛋白的丢失,造成红细胞表面的补体调节蛋白的丢失,特别是CD55(衰变加速因子)和CD59(膜攻击复合物抑制因子),使PNH红细胞被补体攻击而破坏,造成血管内溶血(IVH)、血栓形成及平滑肌功能障碍等一系列与溶血相关的症状,严重影响患者的生活质量,甚至导致死亡。传统治疗方案无法解决补体系统被异常激活的级联反应,造血干细胞移植(HSCT)曾经是PNH治愈的唯一途径。靶向补体成分的补体抑制剂可阻断补体级联反应通路,有效控制PNH的溶血及相关症状,已成为治疗溶血性PNH的一线疗法。近年来,全球多款补体抑制剂相继获批和在中国上市,更多中国患者接受了补体抑制剂治疗。本共识旨在规范和指导不同补体抑制剂在PNH领域的临床应用。
阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria, PNH)是一种罕见的后天获得性溶血性疾病。该病源于造血干细胞发生位于X染色体(Xp22.1)上磷脂酰肌醇聚糖锚生物合成基因突变[1],导致糖基磷脂酰肌醇(glycosylphosphatidylinositol, GPI)锚的合成缺陷,造成锚连蛋白在细胞表面的缺失,尤其是红细胞表面缺乏补体调节蛋白CD55和CD59(均为GPI锚连蛋白),在补体攻击情况下发生溶血,从而带来一系列的临床症状[2-3]。同时,PNH的发生存在免疫攻击导致的骨髓衰竭背景,也被视为骨髓衰竭(bone marrow failure,BMF)疾病之一[2]。血管内溶血(intravascular hemolysis,IVH)、全血细胞减少、血栓形成和平滑肌功能障碍是本病的四大特点。PNH患者可由于各种并发症而导致寿命缩短,在缺乏补体抑制剂治疗的时代,总体5年生存率约为72%,10年生存率约为50%[3]。
近年来,针对不同靶点的补体抑制剂先后在中国获批上市,为PNH患者带来里程碑式的治疗变革。中国也进入了补体抑制剂可及,且日益丰富的新时代,而国内尚无针对抗补体治疗的临床指南或专家共识。然而,面临长期甚至终身的补体抑制治疗,PNH患者急需规范化的疾病治疗方案和全病程管理建议以增加临床获益和降低风险。基于此, 中华医学会血液学分会红细胞疾病(贫血)学组专家以循证医学为基础,制订了本共识,旨在帮助临床医师为PNH患者提供规范化的抗补体治疗和特殊状况和人群的临床管理建议。
1共识制订方法
本共识由中华医学会血液学分会红细胞疾病(贫血)学组发起,参与制定本共识的专家具有较为丰富的PNH诊疗经验,部分专家此前曾参与制定PNH疾病相关共识。专家组成员首先确定共识主题和范围,根据PNH的补体抑制剂治疗和临床管理在PubMed和中国知网及万方数据库中进行文献检索,检索时间截止为2024年5月30日。文献类型包括指南/共识/专家意见/回顾性分析/随机对照临床试验/队列研究/药品说明书等,形成共识文献库。基于研究局限性(风险偏倚)、一致性、直接性、精确性和发布偏倚的可能性,采用GRADE[4](Grading of Recommendations Assessment, Development and Evaluation)系统对文献证据进行评级和推荐强度的制定,并基于证据质量给出强或弱两种推荐强度(表1~2)。执笔组成员根据主题和文献库进行分工和初稿撰写,2024年7月将初稿返回各位专家组成员征求意见,并根据反馈意见进行修改。经过多轮讨论和修改,最终在全体专家成员一致同意下,形成本共识。

2PNH分类及补体抑制剂治疗指征
国际PNH工作组(international PNH interest group, I-PIG)将PNH分为3类[5]:①经典型PNH,该类患者有典型的溶血和血栓形成表现;②合并骨髓衰竭的PNH(BMF/PNH),如合并再生障碍性贫血(aplastic anemia,AA)或骨髓增生异常综合征(myelodysplastic syndrome,MDS);③亚临床型PNH,患者有微量PNH克隆,但没有溶血和血栓的实验室和临床证据。
虽然在多个补体抑制剂治疗PNH的临床研究中,常以PNH克隆>10%和乳酸脱氢酶(lactate dehydrogenase,LDH)≥1.5倍正常值上限(upper limit of normal,ULN)作为筛选入组标准,但在实际启动补体抑制剂治疗时,实验室指标并不是唯一条件。国际上多个PNH指南或专家共识均强调,补体抑制剂治疗时机的选择应综合考虑实验室指标和临床症状[5-8]。由于有些症状是非特异性的,可能并非归因于PNH,需谨慎仔细权衡。
综合各国PNH指南和共识中的建议,对于经典型PNH,以及合并骨髓衰竭的PNH中伴有明显溶血和/或相关症状者,可启动补体抑制剂治疗。对于亚临床型PNH,应监测其PNH克隆变化及临床症状的发展及转归,当出现溶血和/或相关症状时,可启动补体抑制剂治疗[9]。对于妊娠PNH患者,多个共识均推荐应尽快启动补体抑制剂治疗,目前仅限于依库珠单抗(eculizumab)(表3)[5-8]。
3PNH治疗目标的演变
近年来,随着补体抑制剂药物的研发和探索,PNH的治疗目标不断被提高。最先上市的补体末端抑制剂(如依库珠单抗)治疗目标是控制IVH,延长生存[10-12]。新型C5抑制剂改善了由于C5多态性导致的疗效不佳、单抗药物半衰期短,以及静脉输注使用不便利等问题; 但无法解决末端补体抑制后产生的血管外溶血(extravascular hemolysis,EVH),以及溶血控制不佳导致的长期慢性贫血、疲劳等问题[13]。随着近端补体抑制剂的出现,临床试验的终点已从单纯的关注LDH下降,演变为包括减少输血需求、提升血红蛋白(hemoglobin,HGB)水平、LDH降低至较低水平、改善疲劳等复合终点[13]。HGB改善甚至正常化,是新型补体抑制剂追求的治疗目标[14]。
对于未接受补体抑制剂治疗的PNH患者,目前中国已获批依库珠单抗、可伐利单抗及口服的近端补体抑制剂伊普可泮等药物[10,12,15-16];对于已经常规接受C5抑制剂治疗的PNH患者,如果出现疗效不佳,如EVH、突破性溶血(breakthrough hemolysis,BTH)或不耐受等,可以转换近端补体抑制剂——伊普可泮(iptacopan)(图1)[16]。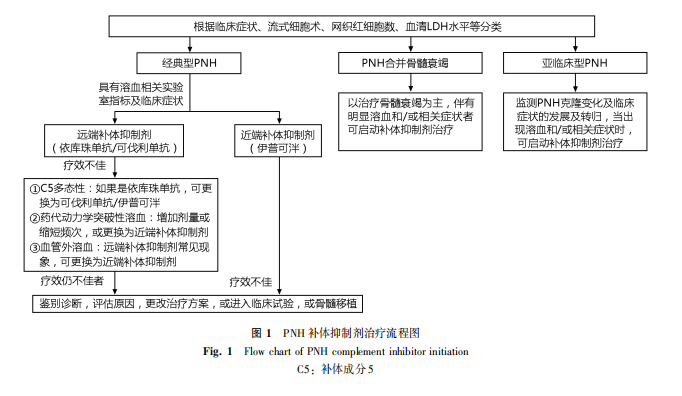
4不同补体抑制剂分类及推荐
推荐意见:
(1)对于未经抗补体治疗的成人PNH患者,满足IVH证据,且出现PNH相关临床症状时,即可启动抗补体治疗(证据等级:高; 推荐级别:强)。
(2)对于既往接受依库珠单抗治疗后有残存贫血的PNH患者,需要谨慎分析贫血原因,如有EVH证据(如Coombs试验阳性、PNH 红细胞膜上出现C3 片段沉积、网织红细胞计数增高等),则考虑转换上游补体抑制剂(证据等级:高; 推荐级别:强)。
(3)对于接受依库珠单抗治疗后LDH控制不佳的患者,可能是基因多态性,也可能是剂量不足导致游离C5激活了补体,需要进一步鉴别(证据等级:高; 推荐级别:强)。
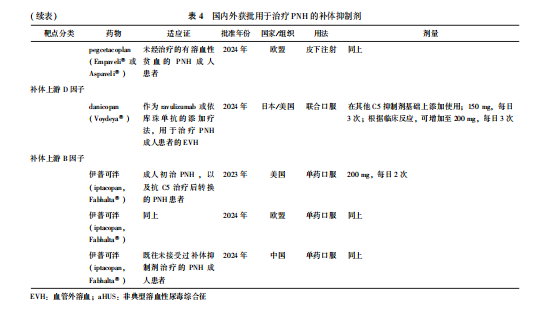
补体抑制剂分为远端(下游)和近端(上游)补体抑制剂。前者包括最先上市的人源化C5抑制剂依库珠单抗,以及随后上市的ravulizumab和可伐利单抗(crovalimab);后者包括国外已经获批上市的C3抑制剂pegcetacoplan(APL-2)、美国、中国获批的B因子抑制剂伊普可泮(LNP023),国外获批的D因子抑制剂(danicopan, BCX9930)等(表4)。本共识只涉及在中国获批上市的补体抑制剂及其治疗推荐。
4.1远端补体抑制剂(靶向C5的补体抑制剂)
4.1.1依库珠单抗
依库珠单抗通过靶向结合补体C5,阻止膜攻击复合物(membrane attack complex,MAC)的形成,抑制血管内PNH红细胞的破坏,减轻IVH[10]。依库珠单抗于2018年在中国获批,于2022年上市,2024年被纳入医保目录,用于成人和儿童的PNH治疗。
与安慰剂组患者相比,接受依库珠单抗治疗的患者LDH水平降低、输血需求减少、疲劳改善显著[17],52周治疗后, 87%的PNH患者溶血减少[10]。除了溶血的改善,每年血栓栓塞率与治疗前相比降低了85%(1.07次事件/100例患者 vs. 7.37 次事件/100例患者)[12]。同时,依库珠单抗极大改变了PNH的自然病程,将生存率提高到与普通人群相似的水平[11]。
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, Allo-HSCT)能从根本上消除PNH克隆,是PNH患者唯一的治愈手段[18],但移植患者的总生存期较差(总死亡率为30%),移植前有血栓形成史患者的死亡风险更高[19]。依库珠单抗的出现也改变了Allo-HSCT在PNH中的治疗地位,使Allo-HSCT在PNH的适应证更改为:重度BMF患者、对依库珠单抗治疗反应不佳、补体抑制剂不可及或有强烈移植意愿的患者[20-21]。
依库珠单抗耐受性良好,常见的不良事件是头痛、鼻咽炎、上呼吸道感染、背痛、恶心、咳嗽[13]。美国上市后10年安全性分析显示,除了脑膜炎球菌感染风险增加,其他最常报告的严重感染为肺炎(11.8%)、菌血症/败血症/感染性休克(11.1%)、尿路感染(4.1%)、葡萄球菌感染(2.6%)和病毒感染(2.5%)[22]。而且,依库珠单抗是目前唯一在妊娠和哺乳期PNH患者中具有安全性和有效性证据的补体抑制剂[23]。
然而,依库珠单抗治疗PNH并不完美,近半数患者无法脱离输血[24]。导致依库珠单抗治疗期间贫血控制不佳的因素很多,包括合并的骨髓衰竭、残留IVH和补体上游C3介导的EVH等[13]。患者基因多态性也可影响依库珠单抗治疗反应,C5变异体Arg885突变干扰药物与C5蛋白结合,导致溶血控制不良,但该突变在中国人群中罕见[25]。补体受体1(complement receptor 1, CR1)基因多态性与依库珠单抗治疗反应不佳有关,表现出更高比例的输血需求(通过影响C3的结合引起 EVH)[26-27]。频繁的静脉给药对患者的依从性要求较高,加上用药后仍有一定程度的输血需求,给患者带来诸多不便[22]。
4.1.2可伐利单抗
可伐利单抗是经连续单克隆抗体回收技术工程化改造的新一代C5抑制剂,半衰期长,可皮下注射,且对C5多态性的患者同样有疗效[28-29]。
在既往接受过依库珠单抗/ravulizumab治疗的PNH患者中,转换为可伐利单抗后,溶血得到持续地控制,安全性良好,部分患者出现一过性的轻度或中度免疫复合物反应[30]。对于初治PNH患者,可伐利单抗非劣效于依库珠单抗,安全性特征相当,且患者生活质量获益更高[31]。COMMODORE 3是一项仅在中国开展的单臂研究,78.7%的患者达到溶血控制,51.0%的患者从基线至第25周脱离输血,且未出现导致治疗中止的不良事件,常见不良事件为上呼吸道感染(47.1%),其安全性特征与C5抑制剂的已知安全性特征一致[32]。
可伐利单抗于2024年在中国获批,用于未接受过补体抑制剂治疗的PNH成人和青少年(≥12岁)患者。
4.2近端补体抑制剂
伊普可泮(iptacopan)是一种特异性补体B因子抑制剂,作用于补体系统C5末端通路的上游,可同时控制IVH和EVH,弥补了抗C5抗体的不足,同时为患者提供了单药口服的治疗选择[33-35]。
对于接受抗C5治疗≥6个月但仍有残留贫血的PNH成人患者, 24周治疗后,82%的患者HGB较基线升高≥2 g/dL,69%的患者HGB≥12 g/dL,而继续抗C5治疗的对照组只有2%的患者HGB≥12 g/dL[34]。抗C5治疗组转换为伊普可泮治疗后,患者HGB水平迅速改善, 90%以上脱离输血[35]。对于初治PNH患者, 92%的患者HGB较基线升高≥2 g/dL,63%的患者HGB≥12 g/dL[34]。同时,伊普可泮显示了较抗C5药物更低的BTH发生率,且不需要停药或者调整剂量[36-37]。
关于安全性,初治PNH患者最常见的不良事件为头痛(28%)、新冠病毒(15%) 和上呼吸道感染(13%),未观察到死亡,也未发生导致治疗中止的不良事件[34]。如果漏服一剂或多剂伊普可泮,建议患者尽快补服一剂(即使与下一次计划给药时间很接近),然后恢复常规给药方案[38]。
伊普可泮于2024年4月在中国获批用于PNH成人患者的一线治疗。伊普可泮是目前获批的疗效最优的补体抑制剂,其临床疗效确切、安全,可口服,进一步提升了PNH治疗目标。
5补体抑制剂治疗注意事项
5.1治疗前疫苗接种
推荐意见:
(4)PNH患者进行抗补体治疗前2周,务必完成疫苗接种,尤其是脑膜炎奈瑟球菌,避免抗体阻断后带来的感染风险(证据等级:高; 推荐级别:强)。
(5)转换补体药物的PNH患者,如果仍处在疫苗保护期限内,则不必重新接种疫苗,接近保护期后补种疫苗即可(证据等级:高; 推荐级别:强)。
(6)接受抗补体治疗的PNH患者一旦发现细菌感染迹象,尽快启动抗生素治疗,抗生素药物可选择青霉素、红霉素、阿莫西林、环丙沙星等(证据等级:中; 推荐级别:强)。
补体抑制剂可能增加荚膜细菌(包括脑膜炎奈瑟球菌、肺炎链球菌和B型流感嗜血杆菌)感染的风险,无论何种补体抑制剂,都需要在首次给药前至少两周,接种或者更新荚膜细菌类疫苗,尤其是脑膜炎奈瑟球菌疫苗。在依库珠单抗10年安全警戒数据中,除了脑膜炎感染,肺炎是第二高发的感染类型(其他类型的感染如菌血症、败血症、尿路感染、葡萄球菌感染和病毒感染均有报道 )[22]。为了避免同时接种多种疫苗可能导致的严重溶血事件,专家组建议PNH患者一次接种一种疫苗。预防性抗生素使用应从补体抑制剂使用开始,坚持到第二种疫苗接种后15 d(表5)。对于出现感染性并发症的PNH患者,不应停止抗补体治疗[39]。
5.2补体抑制剂疗程及治疗期间的监测
推荐意见:
(7)虽然存在极少数的自发缓解现象,但是绝大多数接受抗补体治疗的PNH患者需要终身用药,因为体内存在大量的缺陷红细胞,一旦停药会出现一系列溶血相关的并发症,甚至危及生命(证据等级:高; 推荐级别:强)。
随着补体抑制剂在国内的应用,PNH患者获得了生存期的延长和生活质量的改善。补体抑制剂均需长期不间断用药,因此治疗期间应常规监测血液学情况(如HGB、网织红细胞计数,白细胞,血小板计数)、生化指标改善(如胆红素、铁蛋白、LDH),用来评估补体抑制剂疗效[24,41]。跟踪监测PNH克隆大小、关注并检测可能的感染风险、BTH风险等。对仍然依赖输血的PNH患者进行BTH、血管内外溶血、骨髓衰竭性疾病及其他可能引起贫血原因的分析,寻找潜在原因。补体抑制剂并不能解决突变导致的GPI锚蛋白缺陷,因此在治疗期间,GPI缺陷的红细胞大量堆积,一旦停药,会导致溶血的复发。如停药,需在停药两周内密切监测溶血情况[42]。
作为靶向C5的远端补体抑制剂,依库珠单抗和可伐利单抗只抑制了终末端补体激活,无法避免C3激活带来的EVH,尤其需要注意EVH的鉴别诊断[39]。对于接受口服伊普可泮治疗的患者,需要强调服用的依从性,严格规范治疗,避免突然中断用药带来的溶血风险[38]。
5.3突破性溶血的处理
推荐意见:
(8)BTH发作时,患者可能误以为是残存贫血、疲劳等PNH常见症状,从而放松警惕。需要做好患者管理,提醒BTH 需要注意的体征和症状表现,以便及时发现并调整治疗方案(证据等级:高; 推荐级别:强)。
(9)药物代谢动力学(pharmacokinetics,PK)BTH往往比较规律,可通过增加药物剂量/频次或转换/联用其他新型补体抑制剂解决(证据等级:高; 推荐级别:强)。
(10)药物效应动力学(pharmacodynamics,PD)BTH往往散发,需要结合补体激活条件,严密监测患者HGB、LDH水平,并根据严重程度决定是否进行补体抑制剂剂量或者频率的调整、联合、补充输注红细胞(证据等级:高; 推荐级别:强)。
治疗期间IVH若先改善后复发,称为BTH,表现为血红蛋白尿再现、LDH显著升高和HGB水平骤降,部分患者伴腹痛、发热。BTH的原因可能是PK(如药物有效剂量不足)或PD(如感染或炎症状态引起强烈的补体激活,突破药物的阻断)[43]。10%~27%接受依库珠单抗或ravulizumab治疗的PNH患者因BTH需要提高剂量或缩短治疗间隔[24,44]。10.4% 的 PNH 患者在接受可伐利单抗治疗期间出现 BTH[31]。伊普可泮组 BTH 事件发生率更低,且主要发生在补体激活条件下(PD BTH)[36-37]
PK BTH常发生在下次给药前[13]。欧洲中部PNH专家建议,对于复发性PK BTH,可增加药物剂量/频次,或转换/联用其他新型补体抑制剂[45](表6)。而PD BTH往往散发[43]。2024年美国发布的专家共识将PD BTH定义为,在LDH新升高>1.5×ULN的情况下,HGB急性下降≥1.5 g/dL(与患者的最新评估相比),且已知由补体扩增激活(complement activation amplification,CAC)因素引起(如近期的疫苗接种、感染、手术)。对于已发生BTH的患者,要严密监测HGB、LDH水平,适时进行补体抑制剂剂量或频率的调整、补充输注红细胞 [46](表6)。
5.4特殊人群用药
5.4.1妊娠和哺乳期PNH
推荐意见:
(11)建议计划妊娠或已经妊娠的PNH患者接受依库珠单抗治疗,并维持到产后(证据等级:中; 推荐级别:强)。
妊娠期间补体的激活由胚胎着床触发,补体调节对胎盘发挥保护和损伤的双重作用[47]。补体级联反应的激活会加剧PNH患者的溶血反应[14],在先兆子痫的情况下更是如此[48]。在真实世界报道中,与非妊娠状态相比,妊娠期的PNH患者IVH和贫血通常更严重,输血需求更大[47,49]。即使产后,PNH患者的静脉血栓风险也持续较高[47]。在整个孕产期,PNH孕妇的死亡率高达8%~20%[50]。
依库珠单抗的出现改变了PNH患者的妊娠结局。真实世界研究显示,接受依库珠单抗治疗后,88.9% 的孕妇顺利生产,无死产或者新生儿畸形,无产妇死亡报告[51]。病例报告显示,妊娠期患者接受依库珠单抗治疗后,新生儿血清中补体活性完全正常[52]。
目前,仅依库珠单抗在妊娠PNH患者中有临床数据,被多个国际指南推荐用于妊娠PNH的治疗[5-8]。建议在妊娠前接受依库珠单抗治疗的患者,在妊娠期间继续用药并密切随访,超过50%的患者在分娩前需要增加依库珠单抗的剂量或频率[50]。考虑到产后依旧有血栓风险,建议依库珠单抗的治疗应延长至产后[8,47,50]。
5.4.2儿童PNH
推荐意见:
(12)对于伴随临床症状的未成年PNH患者,建议启动依库珠单抗或者可伐利单抗治疗,并根据说明书调整用药剂量(证据等级:强; 推荐级别:强)。
儿童PNH极罕见,已报道年龄最小的PNH患者为0.8岁,但儿童PNH主要影响群体是青少年[53],与成人PNH不同,青少年和儿童PNH患者常具有更高比例的骨髓衰竭[2,54]。 目前,只有依库珠单抗和可伐利单抗有儿童PNH适应证(后者为12岁以上)。儿童PNH患者接受依库珠单抗治疗后,LDH降低到正常水平,血液参数稳定,未观察到明确的药物相关不良事件;药物浓度检测显示,依库珠单抗浓度大多高于完全补体阻断所需的水平,在未来可能需要进一步探讨儿童患者剂量的优化[55]。依库珠单抗尚未用于体重小于40 kg的PNH患者,对于这类患者,建议参考aHUS剂量方案进行剂量调整[40](表7)。可伐利单抗COMMODORE研究纳入了部分12岁以上青少年PNH患者,获批≥12岁且体重40 kg以上的儿童PNH,其剂量调整主要基于体重[28](表7)。伊普可泮虽然在成人PNH中显示出良好的安全性,但是由于缺少儿童数据,尚未获批儿童适应证。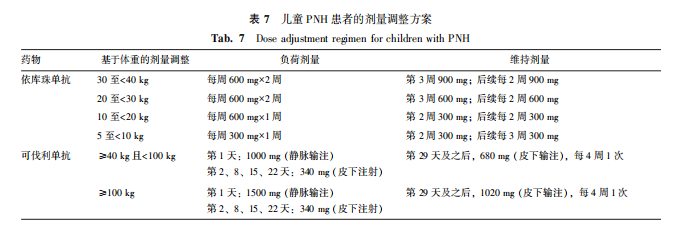
5.4.3合并骨髓衰竭PNH
推荐意见:
(13)对于合并骨髓衰竭的PNH患者,优先针对骨髓衰竭进行治疗。如伴随PNH相关临床症状,可在原治疗方案基础上联合抗补体治疗(证据等级:低; 推荐级别:弱)。
(14)该类型患者需要规律随访,进行PNH克隆监测,密切关注疾病转归(证据等级:高; 推荐级别:高)。
来自中国的PNH回顾研究显示,BMF/PNH和经典型PNH的血栓形成率相似,但BMF/PNH患者发生肾功能损害的概率更高,环孢素暴露时间更长,进展髓系恶性肿瘤的比率更高[56]。多数BMF/PNH患者的PNH克隆相对较小,无溶血及相关并发症,应侧重于骨髓衰竭综合征治疗[3]。在AA患者中出现PNH克隆预示着免疫抑制治疗反应更好,推荐对这些患者进行免疫制剂方案,治疗原则同无PNH克隆的AA患者[8,57]。当BMF/PNH伴有明显的溶血及相关症状,或患者的AA经治疗后,原有PNH克隆扩增,或从无PNH演变为出现PNH克隆和溶血相关症状(如血栓形成等),则启动补体抑制剂治疗。
对于控制PNH溶血症状、降低LDH方面,依库珠单抗在经典型PNH和PNH/AA中疗效相似[58-61]。国际PNH登记研究显示,依库珠单抗和免疫抑制剂合并用药均安全有效,IVH指标得到改善[59]。中国一项单中心研究显示,无论是经典PNH还是PNH/AA,依库珠单抗均有效且安全[61]。
这些研究表明,无论PNH患者伴随的 AA 状态如何,只要符合溶血证据和症状,都可以通过依库珠单抗得到有效的溶血控制。如果患者的骨髓衰竭症状同时存在,则可联合免疫抑制剂同时进行抗骨髓衰竭治疗[3,58-61]。
6结语
随着更多创新靶点补体抑制剂的获批,PNH的治疗已进入新时代,远端补体抑制剂解决了患者的生存问题,近端口服抑制剂在改善溶血的基础上,进一步提高了生活质量,且用药便利,可以控制BTH和治疗/预防EVH。PNH进入了慢性疾病长期管理阶段,需要更多地关注患者治疗依从性、BTH、EVH,以及感染的预防和处理等问题。
未来将基于患者自身因素(年龄、合并症、个人偏好、社会和工作活动、预测依从性等)和疾病特征因素(严重程度、BTH和EVH的发生、合并骨髓功能衰竭等)选择合适的补体抑制剂,甚至联合不同机制的药物(如上下游补体抑制剂联合、补体抑制剂与免疫抑制剂、血小板受体激动剂联合等),以获得最大的治疗效果。
作者贡献:本专家共识由中华医学会血液学分会红细胞疾病(贫血)学组发起,韩冰、张连生、张抒扬共同组建共识制定工作组,牵头制定共识框架,组织全国多学科专家讨论、修改,并审阅定稿。执笔组成员共同起草了共识初稿,专家组成员共同进行讨论并形成修订意见。
利益冲突:所有参与本共识制订的人员均声明不存在利益冲突。
执笔组成员:韩冰(北京协和医院血液科),刘紫薇(北京协和医院血液科),陈苗(北京协和医院血液科),杨辰(北京协和医院血液科),李莉娟(兰州大学第二医院血液科)
参与共识制定和讨论的专家(按姓氏汉语拼音排序):
常春康(上海市第六人民医院);常红(四川大学华西医院);陈苗(北京协和医院);陈彤(复旦大学附属华山医院);戴敏(南方医科大学南方医院);董宝侠(第四军医大学西京医院);范圣谨(哈尔滨医科大学附属第一医院);付蓉(天津医科大学总医院);高素君(吉林大学第一医院);高晓宁(解放军总医院);韩冰(北京协和医院);何川(四川大学华西医院);何广胜(江苏省人民医院);洪梅(华中科技大学同济医学院附属协和医院);黄健(浙江大学附属第一医院);贾晋松(北京大学人民医院);姜中兴(郑州大学附属第一医院);赖永榕(广西医科大学第一附属医院);雷美清(海口市人民医院);李德鹏(徐州医科大学附属医院);李静(西安交通大学第一附属医院);李莉娟(兰州大学第二医院);李文倩(青海省人民医院);李燕(新疆维吾尔自治区人民医院);林丽娥(海南省人民医院);林圣云(浙江省中医院);刘红(南通大学附属医院);刘辉(北京医院);刘立民(苏州大学第一附属医院);刘容容(广西医科大学第一附属医院);刘紫薇(北京协和医院);马艳萍(山西医科大学第二医院);孟凡凯(华中科技大学同济医学院附属同济医院);苗瞄(苏州大学第一附属医院);任金海(河北医科大学第二附属医院);施均(中国医学科学院血液病医院);宋强(山东大学齐鲁医院);田发青(深圳市龙岗区人民医院);佟红艳(浙江大学附属第一医院);王荷花(中山大学附属第一医院);王化泉(天津医科大学总医院);王顺清(广州市第一医院);文钦(重庆新桥医院);徐雅靖(中南大学湘雅医院);杨辰(北京协和医院);杨岩(吉林大学第一医院);曾云(昆明医科大学第一附属医院);张敏(华中科技大学同济医学院附属协和医院);张连生(兰州大学第二医院);张凤奎(中国医学科学院血液病医院);张抒扬(北京协和医院);赵明峰(天津市第一中心医院);郑波(宁夏医科大学总医院);郑以州(中国医学科学院血液病医院);周泽平(昆明医科大学第二附属医院);祝亮方(福建医科大学附属协和医院)。
参考文献
[1]Brodsky RA. Paroxysmal nocturnal hemoglobinuria[J]. Blood, 2014, 124(18):2804-2811.
[2]Urbano-Ispizua A, Muus P, Schrezenmeier H, et al. Different clinical characteristics of paroxysmal nocturnal hemoglobinuria in pediatric and adult patients[J]. Haematologica, 2017, 102(3):e76-e79.
[3]Parker CJ. Update on the diagnosis and management of paroxysmal nocturnal hemoglobinuria[J]. Hematology Am Soc Hematol Educ Program, 2016, 2016(1):208-216.
[4]Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations[J]. BMJ, 2008, 336(7650):924-926.
[5]Patriquin CJ, Kiss T, Caplan S, et al. How we treat paroxysmal nocturnal hemoglobinuria: a consensus statement of the Canadian PNH Network and review of the national registry[J]. Eur J Haematol, 2019, 102(1):36-52.
[6]Canado RD, Araújo AdS, Sandes AF, et al. Consensus statement for diagnosis and treatment of paroxysmal nocturnal haemoglobinuria[J]. Hematol Transfus Cell Ther, 2021, 43(3):341-348.
[7]Schubert J, Bettelheim P,Brümmendorf TH, et al. Paroxysmal nocturnal hemoglobinuria (PNH) [EB/OL]. (2024-09)[2024-11-27]. https://www.onkopedia.com/de/onkopedia/guidelines/paroxysmale-naechtliche-haemoglobinurie-pnh/@@guideline/html/index.html.
[8]Kulasekararaj A, Cavenagh J, Dokal I, et al. Guidelines for the diagnosis and management of adult aplastic anaemia: a British Society for Haematology Guideline[J]. Br J Haematol, 2024, 204(3):784-804.
[9]Brodsky RA. How I treat paroxysmal nocturnal hemoglo-binuria[J]. Blood, 2021, 137(10):1304-1309.
[10]Brodsky RA, Young NS, Antonioli E, et al. Multicenter phase 3 study of the complement inhibitor eculizumab for the treatment of patients with paroxysmal nocturnal hemoglo-binuria[J]. Blood, 2008, 111(4):1840-1847.
[11]Kelly RJ, Hill A, Arnold LM, et al. Long-term treatment with eculizumab in paroxysmal nocturnal hemoglobinuria: sustained efficacy and improved survival[J]. Blood, 2011, 117(25):6786-6792.
[12]Hillmen P, Muus P, Dührsen U, et al. Effect of the complement inhibitor eculizumab on thromboembolism in patients with paroxysmal nocturnal hemoglobinuria[J]. Blood, 2007, 110(12):4123-4128.
[13]Risitano AM, Marotta S, Ricci P, et al. Anti-complement treatment for paroxysmal nocturnal hemoglobinuria: time for proximal complement inhibition? A position paper from the SAAWP of the EBMT[J]. Front Immunol, 2019, 10:1157.
[14]Risitano AM, Peffault de Latour R. How we ('ll) treat paroxysmal nocturnal haemoglobinuria: diving into the future[J]. Br J Haematol, 2022, 196(2):288-303.
[15]Liu H, Xia L, Weng J, et al. Results from the first phase 3 Crovalimab (C5 inhibitor) study (COMMODORE 3): efficacy and safety in complement inhibitor-naive patients with paroxysmal nocturnal hemoglobinuria (PNH)[J]. Blood, 2022, 140(Supplement 1):714-716.
[16]Xu B, Kang B, Chen J, et al. Factor B inhibitor iptacopan for the treatment of paroxysmal nocturnal hemoglobinuria[J]. Blood Rev, 2024, 66:101210.
[17]Hillmen P, Young NS, Schubert J, et al. The complement inhibitor eculizumab in paroxysmal nocturnal hemoglobinuria[J]. N Engl J Med, 2006, 355(12):1233-1243.
[18]Le Garff-Tavernier M, Debliquis AP, Boyer T, et al. Persistence of PNH clones over time: insights from the mid-term analysis of the French nation-wide multicenter prospective observational study[J]. Blood, 2019, 134:1218.
[19]De Latour RP, Schrezenmeier H, Bacigalupo A, et al. Allogeneic stem cell transplantation in paroxysmal nocturnal hemoglobinuria[J]. Haematologica, 2012, 97(11):1666.
[20]Markiewicz M, Drozd-Sokolowska J, Biecek P, et al. Allogeneic hematopoietic stem cell transplantation for paroxysmal nocturnal hemoglobinuria: multicenter analysis by the Polish Adult Leukemia Group[J]. Biol Blood Marrow Transplant, 2020, 26(10):1833-1839.
[21]Du Y, Han B. Advances in hematopoietic stem cell transplantation for patients with paroxysmal nocturnal hemoglobinuria[J]. Transplant Cell Ther, 2021, 27(4):301-307.
[22]SociéG, Caby-Tosi MP, Marantz JL, et al. Eculizumab in paroxysmal nocturnal haemoglobinuria and atypical haemolytic uraemic syndrome: 10-year pharmacovigilance analysis[J]. Br J Haematol, 2019, 185(2):297-310.
[23]Sarno L, Tufano A, Maruotti GM, et al. Eculizumab in pregnancy: a narrative overview[J]. J Nephrol, 2019, 32(1):17-25.
[24]Debureaux PE, Kulasekararaj AG, Cacace F,et al. Categorizing hematological response to eculizumab in paroxysmal nocturnal hemoglobinuria: a multicenter real-life study[J]. Bone Marrow Transplant, 2021, 56(10):2600-2602.
[25] Du Y, Zhang Q, Han B. Genetic variants of C5 and polymorphisms of C3 in Chinese patients with paroxysmal nocturnal hemoglobinuria[J]. Int J Lab Hematol, 2016, 38(4):e84-e85.
[26] Rondelli T, Risitano AM, de Latour RP, et al. Polymor-phism of the complement receptor 1 gene correlates with the hematologic response to eculizumab in patients with paroxysmal nocturnal hemoglobinuria[J]. Haematologica, 2014, 99(2):262-266.
[27]Long Z, Du Y, Li H, et al. CR1 gene polymorphisms in Chinese patients with paroxysmal nocturnal hemoglobinuria[J]. Gene, 2018, 659:149-154.
[28]罗氏(中国)投资有限公司. 可伐利单抗注射液说明书. 批准文号: 国药准字SJ20240007[EB/OL]. (2024-02-06)[2024-11-27]. https://assets.roche.com/f/249469/x/dc4cbe0f74/kefalidankangzhusheye_20240206.pdf.
[29]Nishimura Ji, Usuki K, Ramos J, et al. Crovalimab for treatment of patients with paroxysmal nocturnal haemoglobinuria and complement C5 polymorphism: subanalysis of the phase 1/2 COMPOSER study[J]. Br J Haematol, 2022, 198(3):e46-e50.
[30]Scheinberg P, CléDV, Kim JS, et al. Phase 3 randomized COMMODORE 1 trial: crovalimab versus eculizumab in complement inhibitor-experienced patients with paroxysmal nocturnal hemoglobinuria[J]. Am J Hematol, 2024, 99(9):1757-1767.
[31]Rth A, He G, Tong H, et al. Phase 3 randomized COMMODORE 2 trial: crovalimab versus eculizumab in patients with paroxysmal nocturnal hemoglobinuria naive to complement inhibition[J]. Am J Hematol, 2024, 99(9):1768-1777.
[32]Liu H, Xia L, Weng J, et al. Efficacy and safety of the C5 inhibitor crovalimab in complement inhibitor-naive patients with PNH (COMMODORE 3): a multicenter, Phase 3, single-arm study[J]. Am J Hematol, 2023, 98(9):1407-1414.
[33]Jang JH, Wong L, Ko BS, et al. Iptacopan monotherapy in patients with paroxysmal nocturnal hemoglobinuria: a 2-cohort open-label proof-of-concept study[J]. Blood Adv, 2022, 6(15):4450-4460.
[34]Peffault de Latour R, Rth A, Kulasekararaj AG, et al. Oral iptacopan monotherapy in paroxysmal nocturnal hemoglobinuria[J]. N Engl J Med, 2024, 390(11):994-1008.
[35]Risitano AM, Kulasekararaj A, Roeth A, et al. Factor B inhibition with oral iptacopan monotherapy demonstrates sustained long-term efficacy and safety in anti-C5-treated patients (pts) with paroxysmal nocturnal hemoglobinuria (PNH) and persistent anemia: final 48-week results from the multicenter, phase Ⅲ APPLY-PNH trial[J]. Blood, 2023, 142(Supplement 1):571.
[36]De Latour RP, Kulasekararaj A, Scheinberg P, et al. Clinical breakthrough hemolysis (BTH) during monotherapy with the oral factor b inhibitor iptacopan is generally not severe and managed without treatment discontinuation: 48-week data from the phase iii apply-pnh and appoint-PNH trials in paroxysmal nocturnal hemoglobinuria (PNH)[J]. Blood, 2023, 142 (Supplement 1):1338.
[37]De Castro CM, Patel BJ. Iptacopan for the treatment of paroxysmal nocturnal hemoglobinuria[J]. Expert Opin Pharmac-other, 2024.doi: 10.1080/14656566.2024.2404110.
[38]北京诺华制药有限公司. 盐酸伊普可泮胶囊说明书. 批准文号: 国药准字HJ20240016.[EB/OL](2024-04-24)[2024-11-27].https://www.nhsa.gov.cn/attach/Ypsn2024/ YPSW202400416/YPSW202400416(PPT).pdf.
[39]Girmenia C, Barcellini W, Bianchi P, et al. Management of infection in PNH patients treated with eculizumab or other complement inhibitors: Unmet clinical needs[J]. Blood Rev, 2023,58:101013.
[40]阿斯利康投资(中国)有限公司. 依库珠单抗说明书. 批准文号: 国药准字SJ20180023.[EB/OL].(2023-10-12)[2024-11-27].https://www.nhsa.gov.cn/attach/Ypsn2023/YPSW 202300267/YPSW202300267-W1,W4(ppt).pdf.
[41]Szlendak U, Budziszewska B, Spychalska J, et al. Paroxysmal nocturnal hemoglobinuria: advances in the understanding of pathophysiology, diagnosis, and treatment[J]. Pol Arch Intern Med, 2022,132(6):16271.
[42]中华医学会血液学分会红细胞疾病(贫血)学组. 阵发性睡眠性血红蛋白尿症克隆筛查及补体抑制剂治疗监测中国专家共识(2024年版)[J]. 中华血液学杂志,2024,45(2):109-114.
[43]Notaro R, Luzzatto L. Breakthrough hemolysis in PNH with proximal or terminal complement inhibition[J]. N Engl J Med, 2022, 387(2):160-166.
[44]Brodsky RA, Peffault de Latour R, Rottinghaus ST, et al. Characterization of breakthrough hemolysis events observed in the phase 3 randomized studies of ravulizumab versus eculizumab in adults with paroxysmal nocturnal hemoglobinuria[J]. Haematologica, 2021,106(1):230-237.
[45]BodóI, Amine I, Boban A, et al. Complement inhibition in paroxysmal nocturnal hemoglobinuria (PNH): a systematic review and expert opinion from central Europe on special patient populations[J]. Adv Ther, 2023, 40(6):2752-2772.
[46]Dingli D, De Castro Iii C, Koprivnikar J, et al. Expert consensus on the management of pharmacodynamic break-through-hemolysis in treated paroxysmal nocturnal hemoglobinuria[J]. Hematology, 2024, 29(1):2329030.
[47]Girardi G, Lingo JJ, Fleming SD, et al. Essential role of complement in pregnancy: from implantation to parturition and beyond[J]. Front Immunol, 2020, 11:1681.
[48]Girardi G, Prohászka Z, Bulla R, et al. Complement activation in animal and human pregnancies as a model for immunological recognition[J]. Mol Immunol, 2011, 48(14):1621-1630.
[49]Fieni S, Bonfanti L, Gramellini D, et al. Clinical management of paroxysmal nocturnal hemoglobinuria in pregnancy: a case report and updated review[J]. Obstet Gynecol Surv, 2006, 61(9):593-601.
[50]Kelly RJ, Hchsmann B, Szer J, et al. Eculizumab in pregnant patients with paroxysmal nocturnal hemoglobinuria[J]. N Engl J Med, 2015, 373(11):1032-1039.
[51]Schaap CCM, Heubel-Moenen FCJI, Nur E, et al. Nationwide study of eculizumab in paroxysmal nocturnal hemoglobinuria: evaluation of treatment indications and outcomes[J]. Eur J Haematol, 2023, 110(6):648-658.
[52]Hallstensen RF, Bergseth G, Foss S, et al. Eculizumab treatment during pregnancy does not affect the complement system activity of the newborn[J]. Immunobiology, 2015, 220(4):452-459.
[53]Mercuri A, Farruggia P, Timeus F, et al. A retrospective study of paroxysmal nocturnal hemoglobinuria in pediatric and adolescent patients[J]. Blood Cells Mol Dis, 2017, 64:45-50.
[54]Ware RE, Hall SE, Rosse WF. Paroxysmal nocturnal hemoglobinuria with onset in childhood and adolescence[J]. N Engl J Med,1991,325(14):991-996.
[55]Reiss UM, Schwartz J, Sakamoto KM, et al. Efficacy and safety of eculizumab in children and adolescents with paroxysmal nocturnal hemoglobinuria[J]. Pediatr Blood Cancer, 2014, 61(9):1544-1550.
[56]Du Y, Yang Y, Yang C, et al. Clinical characteristics of 512 eculizumab-naive paroxysmal nocturnal hemoglobinuria patients in China: a single-center observational study[J]. Hematology, 2022, 27(1):113-121.
[57]中华医学会血液学分会红细胞疾病(贫血)学组. 再生障碍性贫血诊断与治疗中国指南(2022年版)[J]. 中华血液学杂志,2022,43(11):881-888.
[58]Choi CW, Jang JH, Kim JS, et al. Efficacy of eculizumab in paroxysmal nocturnal hemoglobinuria patients with or without aplastic anemia: prospective study of a Korean PNH cohort[J]. Blood Res, 2017, 52(3):207-211.
[59]Lee JW, Peffault de Latour R, Brodsky RA, et al. Effectiveness of eculizumab in patients with paroxysmal nocturnal hemoglobinuria (PNH) with or without aplastic anemia in the International PNH Registry[J]. Am J Hematol, 2019, 94(1):E37-E41.
[60]Hill A, de Latour RP, Kulasekararaj AG, et al. Concomi-tant immunosuppressive therapy and eculizumab use in patients with paroxysmal nocturnal hemoglobinuria: an international PNH registry analysis[J]. Acta Haematol, 2023, 146(1):1-13.
[61]王乐宇,胡青林,陈苗,等.依库珠单抗治疗溶血性阵发性睡眠性血红蛋白尿症的中国真实世界研究[J].中华血液学杂志,2024,45(2):184-189.


