专家笔谈 | 免疫肌动蛋白病及致病基因研究进展
中国罕见病联盟
免疫肌动蛋白病是一类主要由肌动蛋白重构相关调控基因突变导致的以免疫缺陷和免疫失调为主要表现的单基因遗传性疾病。肌动蛋白相关调控基因发生变异可导致肌动蛋白活化、延伸、分支、转录等功能缺陷,影响细胞骨架及伪足形成,进一步影响免疫细胞变形、运动、吞噬和黏附等功能,从而表现为感染、自身炎症、自身免疫、易患肿瘤等多种临床表现,临床识别及诊断困难。免疫肌动蛋白病的临床表现多样,包括反复感染、自身免疫、肿瘤倾向等,部分疾病的致病机制已初步阐明。新的免疫肌动蛋白病致病基因鉴定与机制研究、精准治疗靶点发现和药物研发、造血干细胞移植策略改进以及基因治疗是未来研究的重点。 免疫肌动蛋白病发病率低,临床表现多样,容易误诊、漏诊。本文详细阐述肌动蛋白的致病基因缺陷及其临床表现,以期为临床提供参考价值。
原发性免疫缺陷病(primary immunodeficiency disease, PID)又名免疫出生缺陷(inborn errors of immunity, IEI),是由单个基因突变引起免疫细胞/分子数量和(或)功能异常而导致的一组遗传性疾病,以反复感染为主要临床特点,亦可出现自身免疫、自身炎症、过敏、淋巴增殖及肿瘤易患倾向等[1]。PID作为一类重要的单基因遗传病,迄今为止已报道了400余种PID,总体发病率目前尚无准确数据,国内有研究报道中国PID总体发病率在1/10 000~1/5000之间,但每种PID的发病率远低于1/10 000,因此整体收录于《第二批罕见病目录》。免疫肌动蛋白病[2]是主要由肌动蛋白重构相关调控基因突变导致的以免疫缺陷和免疫失调为主要表现的一类PID,可表现为感染、自身炎症、自身免疫、易患肿瘤等多种临床表现,各疾病临床表现多样,部分疾病致病机制尚未阐明,缺乏有效的诊断及治疗措施,有待进一步鉴定致病基因、研究致病机制及相应的造血干细胞移植策略、小分子靶向药物研究。
肌动蛋白是大多数真核细胞中含量最丰富的蛋白质,对维持细胞结构和功能具有重要作用。脊椎动物表达α、β、γ 3种肌动蛋白亚型。其中α与γ肌动蛋白主要分布在肌肉中,α肌动蛋白在肌肉收缩中起关键作用,维持肌肉的结构和功能,γ肌动蛋白则与肌小节、横桥等结构有关,促进肌肉收缩。β肌动蛋白在几乎所有的细胞中均有表达,参与各种细胞的基本结构维持、细胞运动、细胞内物质运输等多种生理过程[3]。3种亚型异构体中的蛋白单体都是球状肌动蛋白,其组装形成极化的细丝称为丝状肌动蛋白,在此过程中肌动蛋白受到多种因子影响,部分因子功能缺失或过度激活可导致肌动蛋白活化、延伸、分支、转录等功能缺陷,影响细胞骨架及伪足形成等功能,而细胞骨架及伪足形成是中性粒细胞、吞噬细胞等免疫细胞发挥细胞变形、运动、吞噬和黏附等功能的基础,细胞骨架及伪足形成功能障碍可导致免疫细胞功能受损,从而导致免疫缺陷。目前已有数种疾病被鉴定,免疫肌动蛋白病相关分子作用机制见图1。本文将通过突变基因在肌动蛋白细胞骨架中的作用机制将目前已知的免疫肌动蛋白病分为肌动蛋白延伸障碍、肌动蛋白活化障碍、伪足形成障碍、肌动蛋白支链形成障碍、骨架调控蛋白转录障碍,分别总结其相关研究进展,为进一步研究和诊治免疫肌动蛋白病提供参考。
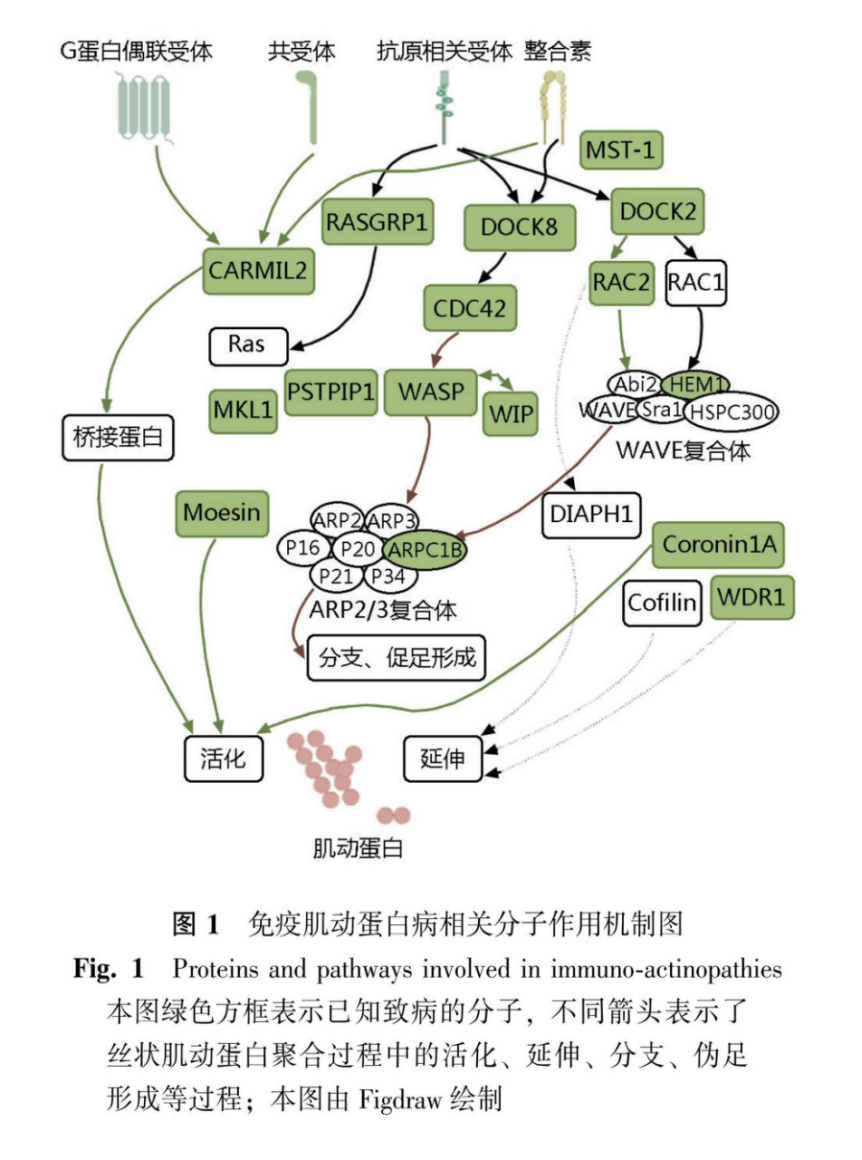
1 肌动蛋白延伸障碍
1.1 ACTB相关免疫缺陷
ACTB基因编码β肌动蛋白,其功能获得性(gain-of-function,GOF)突变所编码的β肌动蛋白变体聚合正常但与Profilin-1结合效率较低,导致1例女性患者出现反复感染、中性粒细胞趋化及呼吸爆发减弱,伴有智力缺陷、身材矮小等临床表现,考虑存在免疫缺陷[4]。而ACTB基因功能缺失性(loss-of-function,LOF)突变目前报道与Baraitser-Winter综合征关系密切且可能导致多种发育畸形,以脑部、心脏及肾脏为主[5],未有明显的免疫紊乱表型。
1.2 WDR1缺陷
WD40重复蛋白1(WD40 repeat protein-1, WDR1),也被称为肌动蛋白相互作用蛋白1 (actin-interacting protein-1, AIP1),主要表达于白细胞、心肌、平滑肌和支气管上皮细胞。小鼠胚胎WDR1的完全缺乏会致死,而人类WDR1常染色体隐性遗传LOF突变可导致中性粒细胞功能缺陷,从而出现反复呼吸道化脓性感染、伤口愈合不良、严重慢性口腔炎和轻度智力障碍等临床表型[6]。此外,由于单核细胞过度产生白细胞介素18(interleukin-18, IL-18),也可导致以周期性发热、免疫缺陷和血小板减少为特征的单基因自身炎症性疾病[7]。目前WDR1缺陷的治疗除造血干细胞移植以外,IL-1受体阻滞剂可间接抑制IL-18而有一定疗效,但总体来说预后欠佳,其有效治疗方式有待进一步研究。
2 肌动蛋白活化障碍
2.1 Coronin1A缺陷
Coronin1A是另外一种WD40重复蛋白,由CORO1A基因编码,与上述WDR1具有协同作用,CORO1A基因发生缺失性突变影响WDR1活化,从而引起免疫肌动蛋白病。Coronin1A完全缺陷患儿可出现初始T细胞及T细胞总数减少,T细胞增殖功能受损以及相关抗体反应降低,表现为减毒活疫苗后严重的水痘-带状疱疹病毒感染,可伴有传染性软疣、疣状表皮发育不良等皮肤黏膜病毒感染,出现反复呼吸系统、泌尿系统感染,且由EB病毒感染引起的B淋巴细胞增生综合征的发生率增高,也可发生早发B细胞淋巴瘤[8]。Coronin1A缺陷的临床表型属于重症联合免疫缺陷(severe combined immunodeficiency disease, SCID),SCID早期的骨髓移植治疗有效,但目前报道有至少4例Coronin1A缺陷患儿移植后仍死于反复感染,仅1例患儿原有B细胞淋巴增殖表现获得缓解,同时在免疫球蛋白支持及预防感染等治疗下存活[9],提示本病预后欠佳,亟待新的有效治疗措施。
2.2 CARMIL2缺陷
CARMIL2由RLTPR基因编码,是一种在活化转录因子家族核因子κB (nuclear factor kappa-B, NF-κB)及CD28直接起桥接作用的蛋白。RLTPR基因的常染色体隐性LOF突变导致CARMIL2缺陷,此类患者缺乏效应T细胞。由于CD28协同信号缺陷导致T细胞活化、分化和功能受损,细胞骨架组织紊乱导致T细胞极化和迁移障碍,临床表现为过敏、细菌和真菌感染、EB病毒相关平滑肌肿瘤为特征的联合免疫缺陷[10]。与单纯的CD28缺乏症不同的是,CARMIL2缺陷尽管也存在皮肤疣状改变和CD4+、CD8+记忆T细胞和Treg细胞的数量降低,但由于CARMIL2缺陷患者同时有记忆B细胞和NK细胞数量降低,以及体液免疫缺陷,因此也可出现多种感染表现,临床表现更具异质性[11]。
2.3 Ⅰ~Ⅳ型白细胞黏附缺陷
白细胞黏附缺陷(leukocyte adhesion deficiency,LAD)引起PID与淋巴细胞功能相关抗原1(lymphocyte function-associated antigen 1, LFA-1)有关。静息白细胞上的LFA-1通过与肌动蛋白网络(cortical actin network, CAcN)的相互作用而保持低活性状态。CAcN主要由丝状肌动蛋白组成,调节BCR信号转导、T细胞的发育及运动与免疫突触形成[12]。白细胞激活过程需要释放CAcN-整合素相互作用,以便LFA-1扩散到细胞膜并激发结合活性,如这一功能受损,可引起Ⅰ、Ⅳ型的LAD。LFA-1的β2整合素亚基缺失导致LAD Ⅰ型,这些患者表现为致死性细菌感染,LFA-1亚基的异常激活与LAD Ⅲ型有关,患者患有严重的细菌和真菌感染,可表现出脐带分离延迟、伤口愈合受损和出血倾向,二者造血干细胞移植治疗有效[13-14]。而LAD Ⅱ型是由于岩藻糖转运蛋白基因突变导致细胞膜糖链缺乏岩藻糖基化所致,此类患者的细菌感染不太严重,可有生长缓慢和智力低下,口服岩藻糖不能有效控制LAD Ⅱ型的临床表现[14]。而LAD Ⅳ型则是在囊性纤维化患者中新发现的一种单核细胞选择性黏附缺陷[15],是由囊性纤维化跨膜电导调节因子基因单基因缺陷引起,具有β2和α4β1整合素缺陷,损害淋巴细胞黏附,导致囊性纤维化。
2.4 Moesin缺陷
MSN基因位于X染色体上,编码Moesin蛋白,Moesin蛋白与Ezrin蛋白和Radioxin蛋白,均为Ezrin-Radioxin-moesin家族的成员,其将肌动蛋白细丝固定在细胞膜上,在细胞骨架重塑中至关重要。Ezrin-Radixin-moesin家族蛋白在人类普遍表达,但Moesin和Ezrin主要在造血系统中表达。 Moesin和Ezrin在细胞形态维持、极化和淋巴细胞免疫突触的形成中起着重要作用。MSN基因LOF突变导致Moesin缺乏症(OMIM#300988)表现为联合免疫缺陷,其特征是早发皮肤、呼吸道、尿路和胃肠道的细菌感染,严重水痘-带状疱疹病毒感染和持续湿疹。患者血液免疫异常表现为血小板减少,持续性T、B和NK细胞减少,间歇性单核细胞减少和中性粒细胞减少,低丙种球蛋白血症[16]。
3 伪足形成障碍
3.1 RASGRP1缺陷
小G蛋白是广泛表达的胞浆水解酶超家族成员,可独立结合并将鸟苷三磷酸(guanosine triphosphate,GTP)水解为鸟苷二磷酸(guanosine diphosphate,GDP)。最著名的亚家族成员是Ras GTP酶,分为5个主要家族:Ras、Rho、Ran、Rab和Arf。Ras家族负责细胞增殖,Rho负责细胞形态,Ran负责核运输,Rab和Arf负责囊泡运输[17]。RAS鸟苷释放蛋白1(Ras guanyl nucleotide-releasing protein, RASGRP1)是一种受甘油二酯调节的核苷酸交换因子,可特异性激活RAS,调节T细胞及B细胞发育、动态平衡和分化。人类RASGRP1缺陷导致以细胞骨架动力学受损为特征的PID。患者表现为反复肺部细菌和病毒感染、严重生长发育迟缓和 EB病毒相关淋巴瘤[18]。
3.2 CDC42/RAC2缺陷
细胞分裂周期蛋白42(cell division cycle 42, CDC42)和Rac家族小GTP酶2(Rac family small GTPase 2, RAC2)均属于Rho GTP酶家族,CDC42负责微棘球和丝状足的形成,以及细胞趋化与极化[19]。常染色体显性CDC42突变表现为巨核细胞减少、发育延迟、面部/脑/心脏畸形、淋巴水肿[20]、白细胞减少症、低丙种球蛋白血症和反复感染等[21]。目前报道的CDC42缺陷患儿仅有一例死亡,死于先天性心脏病,尚未有造血干细胞移植病例。RAC2则可调节肌动蛋白骨架形成及超氧阴离子的产生,是中性粒细胞中RAC的主要成分,RAC2活性不同时可有不同的临床表现。近期一项包括54例RAC2突变患者的临床研究表明,组成型活性 RAS 样突变导致新生儿重症联合免疫缺陷,显性阴性突变导致 LAD 样疾病,而显性激活突变导致联合免疫缺陷[22]。RAC2基因LOF突变可导致常染色体显性RAC2缺乏症导致中性粒细胞功能障碍,表现为中性粒细胞增多、反复致命细菌感染、脐炎、伤口愈合不良和脓肿[23],RAC2-GOF突变则引起重症联合免疫缺陷[24],其机制可能是驱动NOD-样受体热蛋白结构域相关蛋白3炎性小体激活,导致巨噬细胞分泌IL-1β和IL-18,使用小分子药物抑制相关通路可能是RAC2-GOF突变的潜在治疗方式[25]。
3.3 DOCK2/DOCK8缺陷
胞质分裂作用因子2(dedicator of cytokinesis 2, DOCK2)介导RAC2的激活,是一种非典型的鸟嘌呤核苷酸交换因子,激活后以磷脂酰肌醇3,4,5-三磷酸依赖的方式迅速转移到质膜,导致局部CAcN聚合增加。DOCK2主要在外周血白细胞中表达,DOCK2缺陷(OMIM 603122)可导致T细胞趋化缺陷,细菌和病毒感染[26](巨细胞病毒、单纯疱疹病毒和水痘等)[27]。胞质分裂作用因子8(dedicator of cytokinesis 8, DOCK8)与CDC42激活密切相关,介导其GTP/GDP转换,调节树突状细胞的迁移。DOCK8缺乏症(OMIM#243700)表现为严重的和反复皮肤黏膜细菌、病毒和真菌感染、湿疹和过敏[28]。患者IgE往往升高明显,因此DOCK8缺陷又称为常染色体隐性遗传的高IgE综合征。此外,患儿有较高的恶性肿瘤发生率,特别是由于人乳头瘤病毒感染而导致的鳞状细胞癌和B细胞淋巴瘤[29]。造血干细胞移植是目前唯一的治愈方法,存活率约90%[30]。
3.4 HEM1缺陷
肌动蛋白相关复合物2/3(actin-related proteins-2/3 complex,ARP2/3)在肌动蛋白重构中起重要作用,ARP2/3复合物可由WASP或者WAVE 激活。WAVE与其他 4 种蛋白(Abl相互作用蛋白、细胞质脆性X智力低下蛋白相互作用蛋白、造血干祖细胞蛋白300和造血特异性 HEM1蛋白)结合形成五聚体,即WAVE调节复合物(WAVE regulatory complex,WRC)[31],WRC与ARP2/3复合物相互作用。造血蛋白1(hematopoietic protein 1,HEM1)由NCKAP1L基因编码,HEM1缺陷(OMIM#618982)可引起WRC活化异常,引起免疫缺陷、淋巴细胞增生和过度炎症,具有噬血细胞性淋巴组织细胞增生症的特征表现[32]。
4 肌动蛋白支链形成障碍
4.1 WAS综合征和WIP/ARPC1B缺陷
WAS综合征是一个经典的与骨架蛋白形成相关的免疫缺陷综合征,WAS基因编码的WAS蛋白(WAS protein,WASP)仅在造血细胞表达,与WASP结合蛋白(WASP interacting protein, WIP)结合为自抑制状态,在CDC42的激活下与ARP2/3相互作用,促进肌动蛋白丝分支聚合核心的形成。而WAS基因LOF突变可导致典型的以湿疹、免疫缺陷、血小板减少三联征为特征的X连锁免疫缺陷综合征,部分功能缺失的患者则出现以血小板减少为突出表现的X连锁血小板减少症。此外,部分基因突变也能导致WASP激活失调,表现为中性粒细胞减少、骨髓发育不良,为X连锁中性粒细胞减少症[33]。WAS综合征主要以造血干细胞移植治疗,但目前有WASP蛋白激活剂等新型治疗药物研究中,未来有望成为WAS综合征新的治疗方式[34]。
WIP与WASP以复合物的形式存在,并对WASP的稳定性至关重要,WIP缺陷可导致WASP不稳定,从而导致常染色体WAS样原发免疫缺陷[35],总体发病时间早于WAS,免疫缺陷表现更重。而肌动蛋白相关蛋白复合体1B(actin-related protein complex 1B,ARPC1B)作为ARP2/3的一个亚基,与中性粒细胞运动密切相关[36],其缺陷可明显影响ARP2/3功能,从而导致肌动蛋白丝无法正常分支,出现WAS样表现[37]。
4.2 MST-1缺陷
巨噬细胞刺激因子(macrophage stimulating 1,MST-1),又称丝氨酸/苏氨酸激酶4(serine/threonine protein kinase 4,STK4),是一种多功能丝氨酸/苏氨酸激酶,在多个免疫器官中高表达。STK4缺乏导致以B和T淋巴细胞减少、中性粒细胞减少和心脏畸形为特征的PID,不伴血小板异常。STK4增加NF-κB介导的树突状细胞IL-12的产生,并限制氧化应激敏感性[38]。其临床表现除了免疫缺陷相关表现外,存在特征性的疣状表皮发育不良样表现[39]。
4.3 PSTPIP1/Pyrin/MKD缺陷
WASP自抑制状态可由脯氨酸-丝氨酸-苏氨酸磷酸酶相互作用蛋白1 (proline-serine-threonine phosphatase interacting protein 1,PSTPIP1)和PIP2等激活。PSTPIP1基因的杂合子GOF突变导致化脓性关节炎、坏疽性脓皮病、痤疮综合征和PSTPIP1相关的髓系相关蛋白炎症综合征。髓系相关蛋白综合征是由于PSTPIP1 GOF突变显著改变了PSTPIP1自我抑制二聚体关键区域的静电特性,该突变蛋白结构性地激活了潜在的Pyrin蛋白。Pyrin蛋白是炎症小体的关键组成蛋白,是胞浆多蛋白寡聚体家族的成员,负责激活细胞的炎症反应。炎素相关自身炎症伴中性粒细胞皮肤病(the Pyrin-associated autoinflammation with neutro-philic dermatosis, PAAND)和家族性地中海热(familial Mediterranean fever,FMF)是著名的Pyrin相关自身炎症性疾病,这与编码Pyrin的MEFV基因GOF突变引起的Pyrin异常激活有关。近年来,由MVK基因纯合或复合杂合性LOF突变引起的甲氧戊酸激酶缺乏症(mevalonate kinase deficiency,MKD)也有报道与Pyrin的结构性激活有关[40]。
5 骨架调控蛋白转录障碍
5.1 MKL1缺陷
巨核细胞性白血病因子1(megakaryocytic leuke-mia factor 1,MKL1)是肌钙蛋白相关转录因子的一员,通常与球状肌动蛋白形成可逆的复合体,在细胞质中处于非活性状态。当球状肌动蛋白在GTP酶的激活下聚合为丝状肌动蛋白后,MKL1进入细胞核内,刺激相关骨架蛋白基因转录。MKL1基因LOF突变可导致中性粒细胞运动趋化功能严重受损,可表现出严重细菌感染、复发性皮肤脓肿等临床表现[41]。此外,由于MKL1也参与巨核细胞的诱导分化过程,因此部分患者也可由于巨核细胞受损从而表现轻度的血小板减少[42]。此类患者由于中性粒细胞功能缺陷,常因反复感染死亡,造血干细胞移植可能是改善该类患者预后的一种有效方式,2022年首次报道MKL1缺陷患儿进行造血干细胞治疗获得一定疗效[43]。
5.2 CEBPE缺陷
CEBPE基因编码CCAAT/增强子结合蛋白ε,是一种转录因子,其LOF突变可引起常染色体隐性遗传的中性粒细胞特异性颗粒缺乏症1型(neutrophil-specific granule deficiency type 1,SGD-1),表现为反复、严重的细菌感染,造血干细胞移植是该病的主要治疗方式[44]。CEBPE-GOF突变则被认为可导致自身炎症性疾病,患者表现为反复发热和腹痛,可持续4~5 d,伴有皮肤炎症表现,如无菌脓肿、坏疽性脓皮病和口腔溃疡,可能是由于突变CEBPE导致中性粒细胞白细胞介素和干扰素反应基因转录失控[45]。
6 结语
免疫肌动蛋白病是一组新定义的PID。由于肌动蛋白广泛表达于免疫细胞,可导致多种免疫缺陷表现,并伴有多种自身炎症、自身免疫、肿瘤易感、先天畸形等,临床表现多样。对于可疑免疫肌动蛋白病患儿,早期基因和免疫功能检测十分重要;同时,许多免疫肌动蛋白病致病基因尚未阐明,也有许多参与肌动蛋白调控的基因尚未发现人类突变。因此,新的免疫肌动蛋白病致病基因鉴定是未来的方向;疾病的发病机制和治疗靶标未完全阐明,且部分疾病移植治疗效果欠佳,移植也不能解决除免疫和造血系统以外的异常,因此,发病机制、治疗靶点发现、移植技术改进和基因治疗也是未来的研究方向。
作者贡献:马诗韵负责文献检索及文章撰写; 周丽娜、安云飞和赵晓东负责客观指导及文章审校。
利益冲突:所有作者均声明不存在利益冲突。
参考文献
[1]Bousfiha A, Moundir A, Tangye SG, et al. The 2022 update of IUIS phenotypical classification for human inborn errors of immunity[J]. J Clin Immunol, 2022, 42(7): 1508-1520.
[2]Ronzier E, Laurenson AJ, Manickam R, et al. The actin cytoskeleton responds to inflammatory cues and alters macrophage activation[J]. Cells, 2022, 11(11):1806.
[3]Davidson PM, Cadot B. Actin on and around the nucleus[J]. Trends Cell Biol, 2021, 31(3): 211-223.
[4]Cuvertino S, Stuart HM, Chandler KE, et al. ACTB loss-of-function mutations result in a pleiotropic developmental disorder[J]. Am J Hum Genet, 2017, 101(6): 1021-1033.
[5]Burrill N, Crane H, Khalek N, et al. Expansion of the prenatal phenotype of Baraitser-Winter syndrome: presentation of two cases of multiple congenital anomaly syndrome[J].Am J Med Genet A, 2024: e63719.
[6]Pfajfer L, Mair NK, Jiménez-Heredia R, et al. Mutations affecting the actin regulator WD repeat-containing protein 1 lead to aberrant lymphoid immunity[J].J Allergy Clin Immunol, 2018, 142(5): 1589-1604.e11.
[7]Standing AS, Malinova D, Hong Y, et al. Autoinflammatory periodic fever, immunodeficiency, and thrombocytopenia (PFIT) caused by mutation in actin-regulatory gene WDR1[J]. J Exp Med, 2017, 214(1): 59-71.
[8]Moshous D, Martin E, Carpentier W, et al. Whole-exome sequencing identifies Coronin-1A deficiency in 3 siblings with immunodeficiency and EBV-associated B-cell lymphoproliferation[J]. J Allergy Clin Immunol, 2013, 131(6): 1594-1603.
[9]Yee CS, Massaad MJ, Bainter W, et al. Recurrent viral infections associated with a homozygous CORO1A mutation that disrupts oligomerization and cytoskeletal association[J]. J Allergy Clin Immunol, 2016, 137(3): 879-888.e2.
[10]Schober T, Magg T, Laschinger M, et al. A human immunodeficiency syndrome caused by mutations in CARMIL2[J]. Nat Commun, 2017, 8: 14209.
[11]Lévy R, Gothe F, Momenilandi M, et al. Human CARMIL2 deficiency underlies a broader immunological and clinical phenotype than CD28 deficiency[J]. J Exp Med, 2023, 220(2):e20220275.
[12]Dustin ML, Cooper JA. The immunological synapse and the actin cytoskeleton: molecular hardware for T cell signaling[J]. Nat Commun, 2000, 1(1): 23-29.
[13]Etzioni A, Frydman M, Pollack S, et al. Brief report: recurrent severe infections caused by a novel leukocyte adhesion deficiency[J]. N Engl J Med, 1992, 327(25): 1789-1792.
[14]Wolach B, Gavrieli R, Wolach O, et al. Leucocyte adhesion deficiency-a multicentre national experience[J].Eur J Clin Invest, 2019, 49(2): e13047.
[15]Fan Z, Ley K. Leukocyte adhesion deficiency IV. Monocyte integrin activation deficiency in cystic fibrosis[J]. Am J Respir Crit Care Med, 2016, 193(10): 1075-1077.
[16]Bradshaw G, Lualhati RR, Albury CL, et al. Exome sequencing diagnoses X-linked moesin-associated immunodeficiency in a primary immunodeficiency case[J]. Front Immunol, 2018, 9: 420.
[17]Murali A, Rajalingam K. Small Rho GTPases in the control of cell shape and mobility[J]. Cell Mol Life Sci, 2014, 71(9): 1703-1721.
[18]Salzer E, Cagdas D, Hons M, et al. RASGRP1 deficiency causes immunodeficiency with impaired cytoskeletal dynamics[J]. Nat Commun, 2016, 17(12): 1352-1360.
[19]Heasman SJ, Ridley AJ. Mammalian Rho GTPases: new insights into their functions from in vivo studies[J]. Nat Rev Mol Cell Biol, 2008, 9(9): 690-701.
[20]Takenouchi T, Kosaki R, Niizuma T, et al. Macrothrombocytopenia and developmental delay with a de novo CDC42 mutation: yet another locus for thrombocytopenia and developmental delay[J].Am J Med Genet A, 2015, 167a(11): 2822-2825.
[21]Martinelli S, Krumbach OHF, Pantaleoni F, et al. Functional dysregulation of CDC42 causes diverse developmental phenotypes[J]. Am J Hum Genet, 2018, 102(2): 309-320.
[22]Donkó A, Sharapova SO, Kabat J, et al. Clinical and functional spectrum of RAC2-related immunodeficiency[J]. Blood, 2024, 143(15): 1476-1487.
[23]Ambruso DR, Knall C, Abell AN, et al. Human neutrophil immunodeficiency syndrome is associated with an inhibitory Rac2 mutation[J]. Proc Natl Acad Sci USA, 2000, 97(9): 4654-4659.
[24]Lougaris V, Chou J, Beano A, et al. A monoallelic activating mutation in RAC2 resulting in a combined immunodeficiency[J]. J Allergy Clin Immunol, 2019, 143(4): 1649-1653.e3.
[25]Doye A, Chaintreuil P, Lagresle-Peyrou C, et al. RAC2 gain-of-function variants causing inborn error of immunity drive NLRP3 inflammasome activation[J]. J Exp Med, 2024, 221(10):e20231562.
[26]Li W, Sun Y, Yu L, et al. Multiple immune defects in two patients with novel DOCK2 mutations result in recurrent multiple infection including live attenuated virus vaccine[J]. J Clin Immunol, 2023, 43(6): 1193-1207.
[27]Dobbs K, Domínguez Conde C, Zhang SY, et al. Inherited DOCK2 deficiency in patients with early-onset invasive infections[J]. N Engl J Med, 2015, 372(25): 2409-2422.
[28]Zhang Q, Davis JC, Lamborn IT, et al. Combined immunodeficiency associated with DOCK8 mutations[J]. N Engl J Med, 2009, 361(21): 2046-2055.
[29]Engelhardt KR, Gertz ME, Keles S, et al. The extended clinical phenotype of 64 patients with dedicator of cytokinesis 8 deficiency[J].J Allergy Clin Immunol, 2015, 136(2): 402-412.
[30]Aydin SE, Freeman AF, Al-Herz W, et al. Hematopoietic stem cell transplantation as treatment for patients with DOCK8 deficiency[J]. J Allergy Clin Immunol Pract, 2019, 7(3): 848-855.
[31]Han KA, Ko J. Orchestration of synaptic functions by WAVE regulatory complex-mediated actin reorganization[J]. Exp Mol Med, 2023, 55(6): 1065-1075.
[32]Castro CN, Rosenzwajg M, Carapito R, et al. NCKAP1L defects lead to a novel syndrome combining immunodeficiency, lymphoproliferation, and hyperinflammation[J]. J Exp Med,2020,217(12):e20192275.
[33]Candotti F. Clinical manifestations and pathophysiological mechanisms of the Wiskott-Aldrich syndrome[J]. J Clin Immunol, 2018, 38(1): 13-27.
[34]Spriano F, Sartori G, Sgrignani J, et al. A first-in-class Wiskott-Aldrich syndrome protein activator with anti-tumor activity in hematologic cancers[J]. Haematologica, 2024.doi: 10.3324/haematol.2022.282672.
[35]Schwinger W, Urban C, Ulreich R, et al. The phenotype and treatment of WIP deficiency: literature synopsis and review of a patient with pre-transplant serial donor lymphocyte infusions to eliminate CMV[J]. Front Immunol, 2018, 9:2554.
[36]Peterson A, Bennin D, Lasarev M, et al. Neutrophil motility is regulated by both cell intrinsic and endothelial cell ARPC1B[J]. J Cell Sci, 2024, 137(3):jcs261774.
[37]Kahr WH, Pluthero FG, Elkadri A, et al. Loss of the Arp2/3 complex component ARPC1B causes platelet abnormalities and predisposes to inflammatory disease[J]. Nat Commun, 2017, 8: 14816.
[38]Cho KM, Kim MS, Jung HJ, et al. Mst1-deficiency induces hyperactivation of monocyte-derived dendritic cells via Akt1/c-myc pathway[J]. Front Immunol, 2019, 10: 2142.
[39]Gutierrez-Marin PA, Castano-Jaramillo LM, Velez-Tirado N, et al. STK4 deficiency and epidermodysplasia verruciformis-like lesions:a case report[J].Pediatr Dermatol, 2024, 41(1): 96-99.
[40]zkilinnen M, Onat UI, Ugurlu S, et al. Detection of a rare variant in PSTPIP1 through three generations in a family with an initial diagnosis of FMF/MKD-overlapping phenotype[J]. Rheumatology (Oxford), 2023, 62(9): 3188-3196.
[41]Sprenkeler EGG, Henriet SSV, Tool ATJ, et al. MKL1 deficiency results in a severe neutrophil motility defect due to impaired actin polymerization[J]. Blood, 2020, 135(24): 2171-2181.
[42]Smith EC, Teixeira AM, Chen RC, et al. Induction of megakaryocyte differentiation drives nuclear accumulation and transcriptional function of MKL1 via actin polymerization and RhoA activation[J]. Blood, 2013, 121(7): 1094-1101.
[43]Oegema S, Henriet SSV, Van Aerde KJ, et al. First successful allogeneic hematopoietic stem cell transplantation for mkl1 deficiency[J]. J Clin Immunol, 2022, 42(8): 1608-1610.
[44]Banday AZ, Kaur A, Akagi T, et al. A novel CEBPE Variant causes severe infections and profound neutropenia[J]. J Clin Immunol, 2022, 42(7): 1434-1450.
[45]Goos H, Fogarty CL, Sahu B, et al. Gain-of-function CEBPE mutation causes noncanonical autoinflammatory inflammasomopathy[J]. J Allergy Clin Immunol, 2019, 144(5): 1364-1376.


