病例报告|原发性肥厚性骨关节病一例
罕见病联盟
原发性肥厚性骨关节病(PHO),又称厚皮性骨膜病,该病罕见。本文报告一例24岁男性PHO患者。14岁出现双手、双足杵状指/趾,伴腕、踝关节无痛性肿大。面部皮肤增厚,褶皱向心性增加,鼻翼宽大肥厚,痤疮,手足多汗。X线见掌、指骨及趾、跖骨增粗,双侧胫腓骨对称性骨膜骨化。PHO临床表现多样,不易诊断。本例患者不伴关节疼痛,化验检查及垂体MRI等排除肢端肥大症,基因检测提示SLCO2A1基因c.611C>T(p.Ser204Lue)及SLCO2A1基因c.1602C>A(p.Asn534Lys)杂合突变,确诊为PHO。对于幼年起病,杵状指/趾患者应警惕PHO可能,影像中骨膜成骨征象有助于鉴别,基因检测有助于确诊此病。
原发性肥厚性骨关节病(primary hypertrophic osteoarthropathy, PHO),又称厚皮性骨膜病(pachydermperiostosis,PDP),是一种罕见的常染色体遗传病。其发病率极低,男性发病率高于女性,存在两个发病高峰,分别为婴幼儿期和青春期前期。PHO以皮肤及骨骼异常增生为主要特征,主要临床症状为厚皮症、骨膜增生和杵状指/趾,其他症状包括关节炎、关节肿胀、多汗、脑回状头皮、上睑下垂、脂溢性皮炎等。
依据家系分析,目前已发现PHO有常染色体显性遗传和隐性遗传两种遗传模式,HPGD和SLCO2A1为该病的易感基因。既往个案研究报道应用环氧化酶-2(cyclooxygenase-2,COX-2)抑制剂治疗PHO,在改善关节疼痛、关节肿胀、多汗等方面均有一定疗效。
本文报道1例就诊于北京积水潭医院,经基因检测确诊为PHO的患者。经文献复习,患者于本中心接受小剂量COX-2抑制剂治疗。
1 临床资料
患者24岁,男性,因“杵状指/趾,面部褶皱进展10年”就诊。患者于14岁出现双手、双足杵状指/趾,伴腕、踝关节肿大,无发红或皮温升高,无疼痛。同时出现面部皮肤增厚,褶皱向心性增加,鼻翼宽大肥厚,可见轻度色素沉积(图1A)。患者10年来面部反复痤疮,头皮可见脑沟回样改变,伴有手足多汗,随病程进展患者面部褶皱逐渐增多,5年来下蹲困难。病程中无胸闷、活动后呼吸困难等表现,既往无肺部疾病史。父母体健,非近亲婚配,无家族史。
专科查体可见面部皮肤增厚,褶皱向心性增加,鼻翼宽大肥厚;杵状指/趾,指端膨隆,示、中、环、小指远指间关节及拇指指间关节可见凹痕,前臂远端及双腕膨大增粗。双侧踝关节增粗,双足第2趾骑跨第3趾之上,第5趾外翻。四肢易出汗;双腕关节背伸稍受限(图1)。
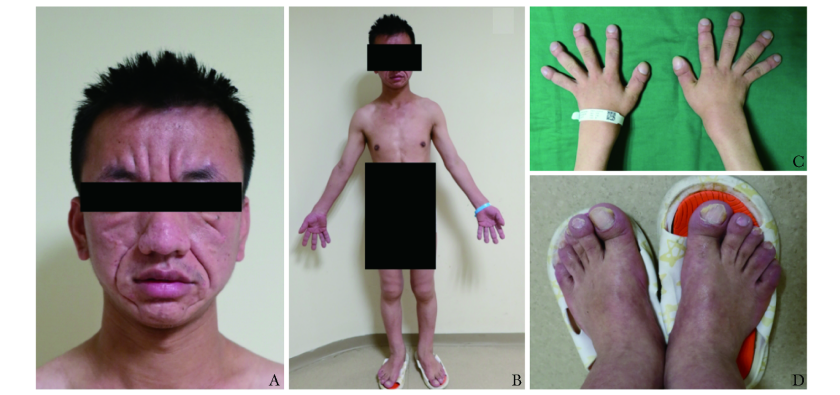
图 1 原发性肥厚性骨关节病(PHO)患者皮肤及四肢改变
Fig.1 Skin and limb changes of the patient with primary hypertrophic osteoarthropathy(PHO)
A.患者面部畸形,褶皱向心性增多,皮肤增厚,伴痤疮;B.患者双前臂、双小腿增大,双踝、双腕关节肥大;C~D.双手各指、双足各趾远节杵状指/趾改变
患者血尿常规、肝肾功及电解质均无异常。生长激素2.490 ng/mL,胰岛素样生长因子-1 112.00 ng/mL,均处于正常范围。总Ⅰ型胶原氨基端延长肽53.4 ng/mL,25-羟基维生素D 13.51 ng/mL。垂体MRI未见异常,胸部CT未见占位、纤维化或炎症性改变。X线见掌指骨、趾跖骨增粗,关节骨质膨大;双尺桡骨远端膨大,双胫腓骨增粗,呈对称性骨膜骨化(图2)。
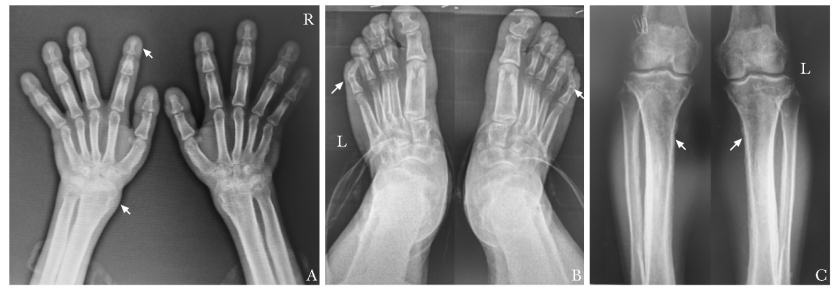
图 2PHO患者X线表现
Fig.2X-rays of the patient with PHO
A.双手正位,可见双尺桡骨远端膨大,掌指骨增粗,远节指骨明显增粗;B.双足正位,可见第5趾外翻,趾跖骨增粗,远节趾骨增粗明显;C.双膝关节正位,可见胫腓骨骨膜增生(箭头示)
患者自青春期(14岁)来逐渐出现杵状指/趾、面部皮肤增厚,X线片提示骨膜增生,同时可见皮脂溢出、毛囊炎、多汗及脑沟回样头皮,符合PHO诊断标准[1]。经与患者及其家属行知情同意后,对患者及其父母采集外周血样本2 mL进行全外显子组测序。检测结果提示SLCO2A1基因c.611C>T(p.Ser204Lue),杂合,常染色体隐性遗传变异,来自母亲,SLCO2A1基因c.1602C>A(p.Asn534Lys),杂合,来自父亲。两处突变位点均为编码区错义突变,既往文献中均有报道见于PHO患者[2],该患者PHO诊断明确。
患者接受COX-2抑制剂依托考昔治疗,剂量为60 mg qd,规律用药2个月后随访患者自觉面部皱褶改善不明显,腕、踝关节肿胀及杵状指/趾改变未见明显缓解,未报告药物相关不良反应。
2 讨论
肥厚性骨关节病(hypertrophic osteoarthropathy,HOA)以杵状指/趾及皮肤增厚为主要表现,多继发于肝癌、肺心病或肝硬化[3]。杵状指/趾是HOA的特征性表现,但HOA临床表现异质性极大,皮肤明显增厚者应注意与肢端肥大症鉴别,伴关节疼痛者易被误诊为反应性关节炎[4]。而无系统性原发病的HOA称为PHO,又称PDP,极为罕见,发病率无法统计。PHO有两个发病高峰,分别为婴幼儿期和青春期前期,男女发病率比约9:1[5],主要临床特征为杵状指/趾及明显的面部皮肤增厚,伴有或不伴有关节疼痛[2]。尽管杵状指/趾畸形易识别,但PHO极为罕见,患者常反复检查而难以确诊。本例患者于青春期出现杵状指/趾畸形,曾就诊多家医院均未能确诊。提示临床医师对无基础疾病但存在杵状指/趾的年轻患者,在排除肢端肥大症诊断后,应警惕PHO。
Sinha等[1]于1997年提出了PHO的临床诊断标准,包括3条主要标准(杵状指/趾、皮肤增厚、骨膜增生)和9条次要标准(皮脂溢出、毛囊炎、多汗、关节炎、指趾端骨质溶解、胃溃疡、植物神经综合征、肥厚性胃病和脑回状头皮),前者为该病的主要临床特征;符合3条主要标准为完全型,2条为不完全型,1条为轻型。该患者同时存在杵状指/趾、面部皮肤增厚和胫腓骨骨膜增生,合并皮脂溢出、脑回样头皮、多汗,临床诊断为完全型PHO。近年来基因检测技术的发展为PHO诊断提供了帮助,本例患者基因检测为SLCO2A1基因突变,最终确诊PHO。对怀疑PHO的患者,基因检测可减少就诊次数,缩短诊断时间。
PHO依据其突变基因和遗传模式,可分为:①PHO常染色体隐性1型遗传,致病基因为HPGD基因[6];②PHO常染色体隐性2型遗传,致病基因为编码前列腺素转运蛋白的SLCO2A1基因;③PHO常染色体显性遗传,致病基因为SLCO2A1基因[7]。
早期家系研究已证实PHO存在常染色体显性和常染色体隐性的遗传模式[7]。2021年,Xu等[8]报道了多个SLCO2A1基因单等位基因突变引起PHO发病的家系,证实了SLCO2A1基因在PHO患者中存在常染色体显性遗传模式。目前SLCO2A1基因已报道了数十个突变位点,该患者及其父母的全外显子组测序提示患者SLCO2A1基因c.611C>T(p.Ser204Lue)及SLCO2A1基因c.1602C>A(p.Asn534Lys)杂合变异,变异基因分别来自母亲及父亲。前者于2018年由Jin等[9]报道1例常染色体隐性遗传病例,SIFT预测为致病性错义突变。后者于2013年由Zhang等[10]报道1例,同样为常染色体隐性遗传。
PHO的发病机制常被认为与前列腺素E2(prostaglandin E2,PGE2)相关。HPGD基因编码的15-羟前列腺素脱氢酶是前列腺素降解的主要酶[6],而SLCO2A1基因编码的前列腺素转运蛋白是介导PGE2跨膜进入细胞的主要酶[11],HPGD基因与SLCO2A1基因的遗传抑制均会引起PGE2分解代谢异常[12],并引起血清PGE2水平升高[13]。
PGE2在PHO患者杵状指的出现及关节疼痛中起重要作用,增高的PGE2促使血小板于指端毛细血管聚集,导致指端组织增生膨大[14]。PHO患者可出现尿PGE2水平升高,血PGE2相比健康人群也有轻度升高[15]。临床上,能够降低PGE2水平的COX-2抑制剂可用于PHO患者的治疗。系统综述表明[16],接受COX-2抑制剂的39例PHO患者中,70%患者的关节痛及关节炎减轻,提示COX-2抑制剂能够缓解PHO患者的关节疼痛。Yuan等[17]试验表明,入组的29例PHO患者接受COX-2抑制剂治疗后,血、尿PGE2水平均有下降,且患者的关节肿胀、厚皮症、多汗均有所改善,持续用药3个月,未出现不良反应。
目前对PHO的治疗尚缺乏长期随访结果,药物停用后效果不明,对患者面容异常的治疗尚缺乏证据。PGE2升高可引起细胞增殖及血管生成,PHO患者面部皮肤增厚和杵状指/趾的病理表现类似[18]。Shakya等[16]于2018年报道了一个PHO家系在接受6个月依托考昔治疗后,面部褶皱均显著减少,提示COX-2抑制剂可改善PHO患者的皮肤增厚、面容异常。尽管本例患者无关节疼痛表现,但其腕、踝关节肿胀,手足多汗,面部皮肤增厚明显且呈进行性加重,结合已有文献报道,该患者接受COX-2抑制剂依托考昔治疗,用药2个月后患者面部褶皱自觉改善不明显但无明显进展,可能与患者用药时间短有关,且评价面部改变为患者主观评判,缺少客观标准,后续将展开长期随访。PHO患者面部褶皱增多、皮肤增厚的药物疗效仍需要长期随访。
PHO是一种罕见的常染色体遗传病,常染色体隐性2型遗传与SLCO2A1基因突变相关,好发于婴幼儿期和青春期前期男性,随生长发育出现进行性面容改变及双侧手足杵状指/趾。对起病年龄早、既往无肺部疾病的杵状指/趾患者应考虑PHO可能,基因检测能够明确诊断。该病目前尚无治疗指南,PGE2在PHO发病过程中起重要作用,已有报道提示COX-2抑制剂能够缓解PHO患者关节疼痛及肿胀,并改善面部皮肤褶皱,但其确切效果及其长期疗效仍需要进一步研究。
作者贡献:赵宗璇负责整理资料、文献复习和论文撰写;孙丽颖、陈佳、王棪嫒、陈丹、左庆瑶提供病例及指导诊治;孙丽颖、邓微、田文指导论文撰写及修改。
利益冲突:所有作者均声明不存在利益冲突。
参考文献
[1]Sinha GP,Curtis P,Haigh D,et al.Pachydermoperio-stosis in childhood[J].Br J Rheumatol,1997,36(11):1224-1227.
[2]Lu Q, Xu Y, Zhang Z, et al.Primary hypertrophic osteoarthropathy: genetics, clinical features and management[J].Front Endocrinol (Lausanne),2023,14:1235040.
[3]Martínez-Lavín M.Hypertrophic osteoarthropathy[J].Best Pract Res Clin Rheumatol,2020,34(3):101507.
[4]Martínez-Lavín M,Matucci-Cerinic M,Jajic I,et al.Hypertrophic osteoarthropathy: consensus on its definition, classification, assessment and diagnostic criteria[J].J Rheumatol,1993,20(8):1386-1387.
[5]Li SS, He JW, Fu WZ, et al.Clinical, biochemical, and genetic features of 41 han Chinese families with primary hypertrophic osteoarthropathy, and their therapeutic response to etoricoxib: results from a six-month prospective clinical intervention[J].J Bone Miner Res, 2017,32(8):1659-1666.
[6]Diggle CP,Carr IM,Zitt E,et al.Common and recurrent HPGD mutations in Caucasian individuals with primary hypertrophic osteoarthropathy[J].Rheumatology (Oxford),2010,49(6):1056-1062.
[7]Castori M, Sinibaldi L, Mingarelli R, et al. Pachydermoperiostosis: an update[J].Clin Genet,2005,68(6):477-486.
[8]Xu Y, Zhang Z, Yue H, et al.Monoallelic mutations in SLCO2A1 cause autosomal dominant primary hypertrophic osteoarthropathy[J].J Bone Miner Res,2021,36(8):1459-1468.
[9]Jin P,Zhang Q,He H,et al.Two cases of primary hypertrophic osteoarthropathy with SLCO2A1 gene mutations[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2018,43(1):100-105.
[10]Zhang Z,He JW,Fu WZ,et al.A novel mutation in the SLCO2A1 gene in a Chinese family with primary hypertrophic osteoarthropathy[J].Gene,2013,521(1):191-194.
[11]Nigam SK.The SLC22 transporter family: a paradigm for the impact of drug transporters on metabolic pathways, signaling, and disease[J].Annu Rev Pharmacol Toxicol,2018,58:663-687.
[12]Nakanishi T,Nakamura Y,Umeno J.Recent advances in studies of SLCO2A1 as a key regulator of the delivery of prostaglandins to their sites of action[J].Pharmacol Ther,2021,223:107803.
[13]Coggins KG,Coffman TM,Koller BH.The hippocratic finger points the blame at PGE2[J].Nat Genet,2008,40(6):691-692.
[14]Kawamoto R,Kikuchi A,Ninomiya D,et al.Clubbed digits presumably caused by lubiprostone[J].Intern Med,2021,60(5):2499-2502.
[15]林园园.原发性肥厚性骨关节病骨吸收指标变化及骨微结构改变[D].太原:山西医科大学, 2016.
[16]Shakya P,Pokhrel KN,Mlunde LB,et al.Effectiveness of non-steroidal anti-inflammatory drugs among patients with primary hypertrophic osteoarthropathy: a systematic review[J].J Dermatol Sci,2018,90(1):21-26.
[17]Yuan L,Liao RX,Lin YY,et al.Safety and efficacy of cyclooxygenase-2 inhibition for treatment of primary hypertrophic osteoarthropathy: a single-arm intervention trial[J].J Orthop Translat,2019,18:109-118.
[18]Tanese K,Niizeki H,Seki A,et al.Infiltration of mast cells in pachydermia of pachydermoperiostosis[J].J Dermatol,2017,44(11):1320-1321.


