论著|2023年度中国、美国、欧盟、日本批准上市罕见病用药概览与分析
中国罕见病联盟
目的 汇总并分析2023年中国、美国、欧盟及日本的罕见病用药上市概况,为中国医药企业、医药管理和新药研发部门提供实证参考。方法 通过中国、美国、欧盟、日本的药品监督管理官方机构发布的2023年药品上市数据,梳理罕见病用药上市概况,对其适应证、上市日期、在中国研发状态、治疗领域、特殊审评审批途径等进行分析。 结果 2023年美国上市28种孤儿药,抗肿瘤领域占比最高,为32.1%(9/28);欧盟上市17种孤儿药,抗肿瘤领域占比最高,为47.0%(8/17);日本上市22种孤儿药;中国上市45种罕见病用药。2023年欧盟及日本上市的孤儿药已在中国进入临床试验/上市申请中/批准临床/临床申请中的比例均已超过70%(日本86.4%,欧盟70.6%)。结论 中国目前尚无孤儿药资格认定体系,但2023年中国在4个国家和国际组织中上市罕见病用药数量最多,体现了中国罕见病目录对药物研发充分的引导作用;同时中国药品审批审评改革和罕见病目录发布时间尚短,罕见病用药审批和研发仍处于追赶阶段。
国际社会对罕见病的认定标准存在一定的差异:美国罕见病定义为每年患病人数低于20万人的疾病[1-2];日本罕见病定义为患病人数低于5万人,或患病率低于1/2500的疾病[3];欧盟罕见病定义为发病率低于1/2000的慢性、渐进性且危及生命的疾病[4];中国目前以目录形式确定罕见病病种,2018年5月11日国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》,涉及121种罕见病[5];2023年9月18日国家卫生健康委员会等6部门联合制定了《第二批罕见病目录》,涉及86种罕见病[6]。罕见病药物,又名“孤儿药”,是指用于治疗、预防、诊断罕见病的药品。罕见病发病率低,其临床试验成本高、目标市场小、获利能力差,仅凭市场机制难以有效激励企业研发和生产孤儿药。美国、欧盟、日本等国家和国际组织先后出台了一系列孤儿药相关法规激励药品研发及创新,基于国际社会各国孤儿药制度变迁和药品研发绩效的事实,本研究探索中国、美国、欧盟及日本4个国家和国际组织2023年度获批上市的罕见病用药概况,为中国临床罕见病患者的诊治提供药物依据,为罕见病药物治疗的管理提供参考。
1 资料与方法
1.1 一般资料
根据美国食品药品监督管理局(Food and Drug Administration, FDA)孤儿药认定和批准在线数据库[7]、Drugs@FDA数据库[8]、中国国家药品监督管理局(National Medical Products Administration, NMPA)药品数据库[9](中国大陆地区数据,未包括港、澳、台地区)、日本医疗器械审评审批机构和日本药品监督管理局(Pharmaceuticals and Medical Devices Agency, PMDA)在线数据库[10-11]、欧洲药品管理局(European Medicines Agency, EMA)在线数据库[12],“药智网”“Insight数据库”等辅助搜集工具获取2023年1月1日至12月31日4个国家和国际组织上市的罕见病用药通用名、商品名、上市时间、适应证、治疗领域以及为加快上市在获批过程中使用的特殊审评审批途径等信息。
1.2 方法
对上述资料来源获取的2023年4个国家和国际组织的罕见病用药信息进行获批适应证、治疗领域、上市日期、特殊审评审批途径,以及中国的研发状态(国外上市但国内未上市)的总结概况及分析讨论。信息检索、梳理和统计分析工作均由双人核对完成,以确保数据准确。
1.3 统计学分析
本研究采用描述性统计学方法,通过频数(构成比)对上述计量资料进行统计描述。
2 结果
2.1 美国FDA2023年批准孤儿药数量分析
2023年度美国FDA药品审评与研究中心(Center for Drug Evaluation and Research, CDER)共计批准55种新药上市,包括新药申请下的新分子实体和作为生物制剂许可证申请下新的治疗生物产品,其中28种(50.9%,28/55)获孤儿药资格认定,如表1所示。20种孤儿药(71.4%,20/28)使用了特殊审评审批途径。抗肿瘤领域占比最高,为32.1%(9/28)。28种孤儿药新药成分中1种在临床申请中,7种在临床试验中,5种在上市申请中,1种已批准临床,1种已获文号。同时2023年全年美国FDA共计指定376个孤儿药资格,批准92个孤儿药适应证上市,除上市新药(28种孤儿药及3种非罕见病适应证新药)外,还包括61个非新药孤儿药适应证(表2)。
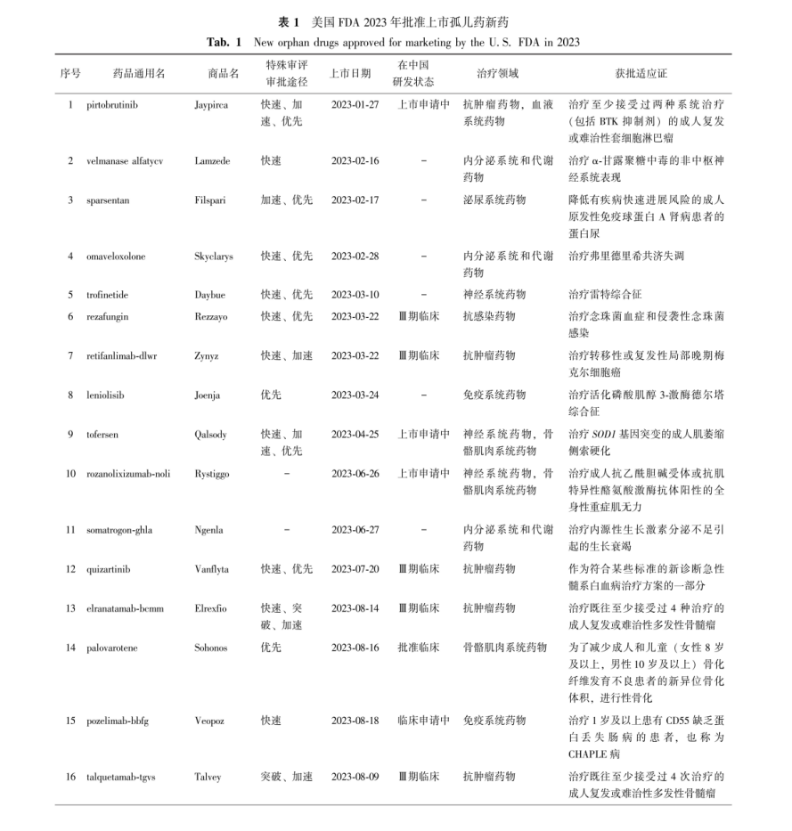
表 1美国FDA 2023年批准上市孤儿药新药
Tab.1New orphan drugs approved for marketing by the U.S. FDA in 2023
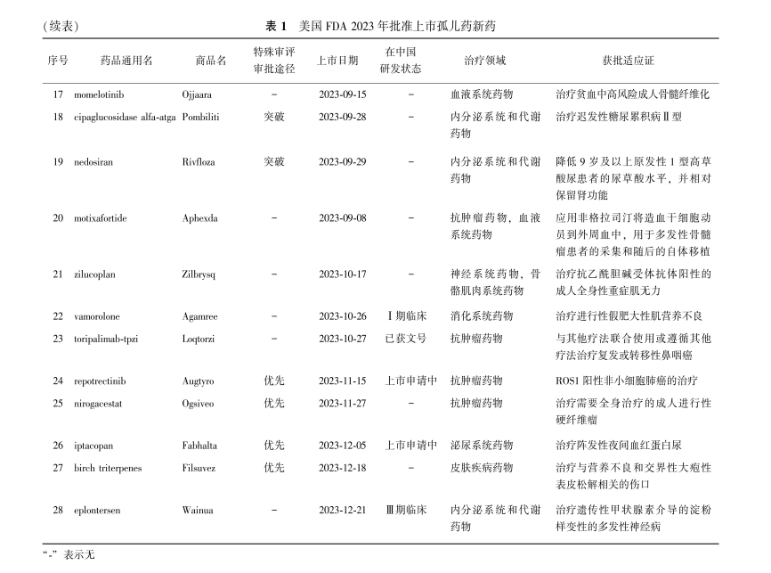
(续表)表 1美国FDA 2023年批准上市孤儿药新药
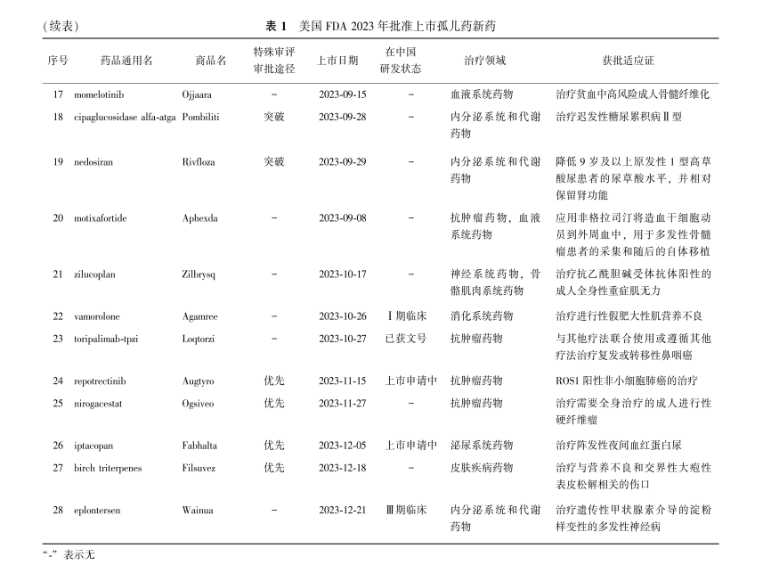
表 2美国FDA 2023年批准非新药孤儿药适应证
Tab.2U.S. FDA approved non-new orphan drug indications in 2023

(续表)表 2美国FDA 2023年批准非新药孤儿药适应证
2. 2 欧盟EMA2023年批准孤儿药数量分析
欧盟孤儿药(审评)委员会(Committee for Orphan Medicinal Products,COMP)将药物分为4类:非孤儿新药、孤儿药、生物类似药和仿制药/知情同意申请。2023年EMA上市授权有77种新药,包括39种新活性物质、17种孤儿药(22.1%,17/77)、14种非专利药和7种生物类似物[13]。同时,2023年欧盟EMA共计认定孤儿药资格130条。17种孤儿药新药相关信息如表3所示,抗肿瘤领域占比最高,为47.0%(8/17)。4种孤儿药使用了特殊审评审批通道,6种孤儿药成分在中国已获文号,4种药物在临床试验阶段,2种药物在上市申请中。欧盟EMA也采取多种措施加速新药审批,包括:①先进疗法产品;②加速审批;③有条件的上市许可;④特殊情况下的上市许可;⑤优先药物计划(priority medicines,PRIME)。
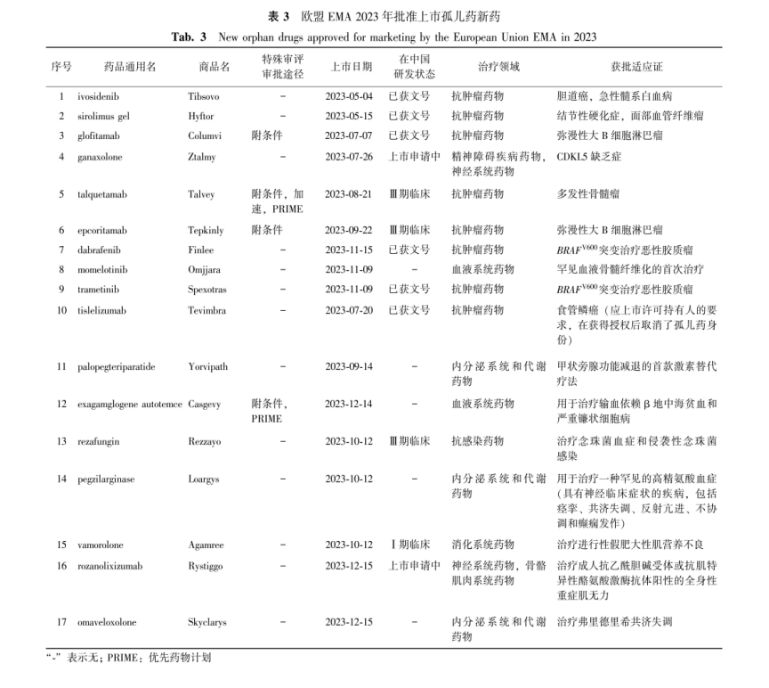
表 3欧盟EMA 2023年批准上市孤儿药新药
Tab.3New orphan drugs approved for marketing by the European Union EMA in 2023
2.3 日本PMDA2023年批准孤儿药数量分析
根据日本新药的定义[14],2023年日本PMDA共计批准106种新药,其中孤儿药新药22种(表4),占新药20.8%(22/106),3种孤儿药通过特殊审评审批途径上市(13.6%,3/22),抗肿瘤领域孤儿药新药占比最高(36.4%,8/22)。15种孤儿药成分在中国已获得文号(68.2%,15/22),2种在中国进入Ⅲ期临床试验阶段,2种处于上市申请中阶段。

表 4日本PMDA 2023年批准上市孤儿药新药
Tab.4New orphan frugs spproved for marketing by Japan PMDA 2023

(续表)表 4日本PMDA 2023年批准上市孤儿药新药
2.4 中国NMPA2023年批准罕见病用药数量分析
中国NMPA在2023年全年批准罕见病用药45个品种(未包括化药4类罕见病用药),具体见表5,其中15个品种(33.3%,15/45)通过优先审评审批程序得以加快上市,1个附条件批准上市[15]。
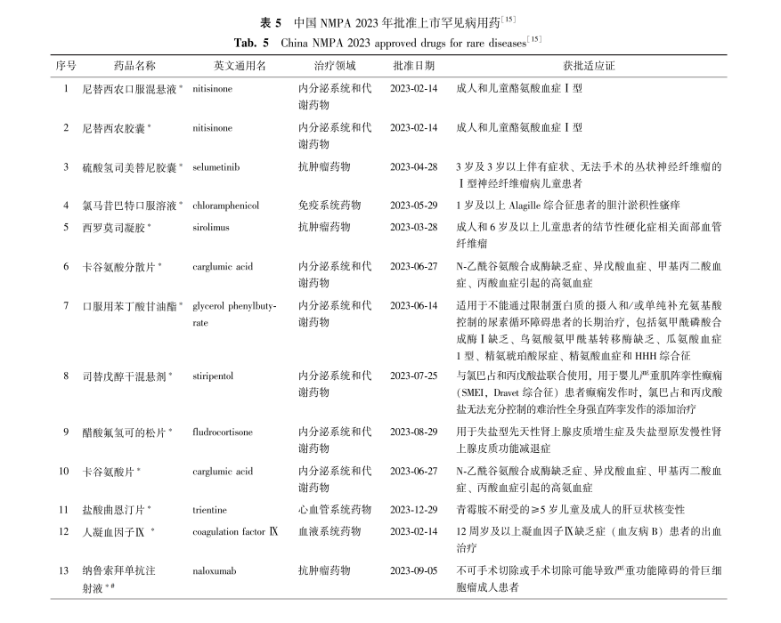
表 5 中国NMPA 2023年批准上市罕见病用药[15]
Tab.5China NMPA 2023 approved drugs for rare diseases[15]

(续表)表 5中国NMPA 2023年批准上市罕见病用药[15]
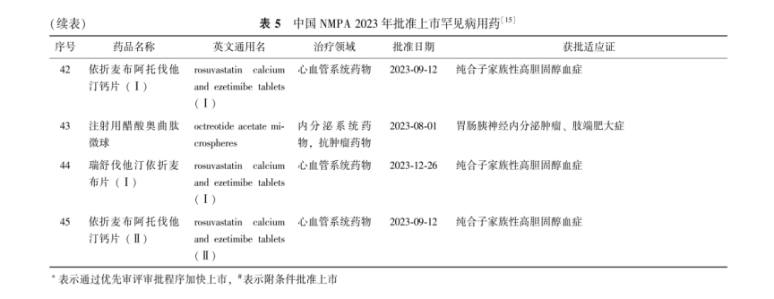
(续表)表 5中国NMPA 2023年批准上市罕见病用药[15]
2.5 国内外2023年批准孤儿药上市概况
如图1、2所示,中国2023年全年上市罕见病用药数量在4个国家和国际组织居首(45种),也显示中国对于罕见病用药可及性的重视和政策倾向的有利结果;美国上市孤儿药新药使用特殊审批途径占比最高(71.4%),提示美国对于创新药孤儿药的上市重视;2023年欧盟及日本上市孤儿药中已在中国进入临床试验/上市申请中/批准临床/临床申请中的比例均已超过70%(日本86.4%,欧盟70.6%),提示全球同步研发的格局,以及中国审批的追赶。由于中国罕见病目录实际所面向的适应证明显少于国外“孤儿药”认定时所面向的适应证,在此情况下中国的批准数量仍高于其他国家和国际组织,也体现了中国两批罕见病目录对药物研发的引导作用,以及临床所最急需,同时数量更多,也说明中国药品审批审评改革和罕见病目录发布时间尚短,仍处于追赶阶段。
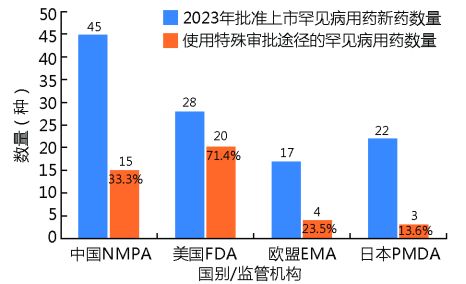
图 1 4个国家和国际组织2023年上市罕见病用药数量
Fig.1 Numbers of rare disease drugs launched in four countries and international organization in 2023
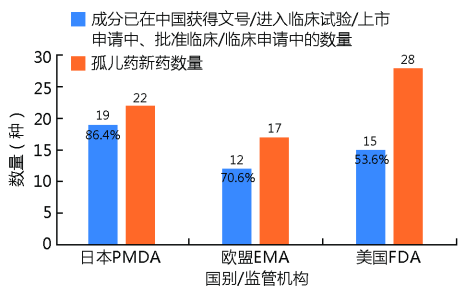
图 2 2023年日本、欧盟、美国上市孤儿药新药在中国上市阶段数量
Fig.2Numbers of the marketing stage of orphan drugs in Japan,the European Union and the United States in China in 2023
3 讨论
美国、欧盟、日本等发达国家和国际组织已于二十世纪末先后建立并后续完善孤儿药及罕见病政策法律法规体系,极大地激励孤儿药研发及上市,提高了孤儿药的可及性。美国于1983年颁布《孤儿药法案》,2002年颁布《罕见病法案》《处方药使用费用法》,2010年颁布《2010年创建希望法案》对儿童用孤儿药进行开发鼓励,2017年美国FDA发布《罕见病药物现代化计划》,要求在90 d内将提交时间超过120 d的孤儿药资格申请进行处理,以解决积压问题[16]。目前美国FDA孤儿药研发激励政策包括免除新药申请费;罕见病药物可通过优先审评、加速审评、快速通道、突破性治疗等方式进行加速审批;减免临床试验费用;7年市场独占期等。2022年美国FDA宣布启动“加速罕见病治疗项目”(Accelerating Rare Disease Cures Program)[17],进一步加速有效安全的罕见病治疗方法的开发。
1999年底,欧洲议会通过《孤儿药品条例》制定欧盟指定孤儿药物的程序,确定开发指定孤儿药并投放市场的激励措施,成立COMP,EMA将COMP意见发送给欧盟委员会,欧盟委员会负责授予孤儿药称号。欧盟委员会对欧盟孤儿药监管框架的优缺点进行了全面审查,评估发现《孤儿药品条例》促进了罕见病患者药物的开发和供应[18]。欧盟EMA在促进罕见病用药的研发与授权上市方面均发挥着重要作用。EMA 发布了《欧盟成员国激励措施清单》[19],并定期更新内容。目前欧盟罕见病药物研发支持政策包括减免申请费用,纳入集中式审批程序,与美国FDA 设立共同认定孤儿药的申请程序,10年市场独占期等;审批上市包括加速审批、有条件审批、特殊审批、PRIME计划等加速通道。
日本于1993年颁布《罕用药管理制度》,并在《药事法》中鼓励孤儿药研发;2002年修订《药事法》引入孤儿药研发、认定具体条款;2005年设立国家生物药品创新协会负责孤儿药研发资助、税收优惠授权。研发激励政策方面包括日本国家生物医药研究中心资助费用不超过研发费用的50%,资助3年;总研究费用超之前5年中3年的年总研究费用平均值,则当年总研究费用的15%可从公司税中减免;优先审批,减免评审费用,同时延长再次审批时间;市场独占期10年等。
近年来,中国通过一系列政策保障罕见病的药物治疗。如罕见病药物的优先审批审评、附条件上市等[20]。国家药品监督管理局药品审评中心于2022年发布《罕见疾病药物临床研发技术指导原则》和《罕见疾病药物临床研究统计学指导原则(试行)》[21-22]为开展罕见病用药临床研发提供建议和参考。2022年中国NMPA发布《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》[23],提出对获批上市的罕见病用药新药给予≤7年的市场独占期。2023年3月3日,国家药审中心发布《药审中心加快创新药上市许可申请审评工作规范(试行)》,依托现有工作,集中审评资源靠前服务指导,鼓励儿童专用创新药、用于治疗罕见病的创新药及纳入突破性治疗药物程序的创新药研发,加快创新药上市速度。随着中国鼓励创新药研发政策的不断出台、药品审评审批机制的逐步完善及药企研发能力的持续提升,创新药的研发环境将进一步改善。新药研发对各个疾病领域的覆盖将趋于平衡,缓解抗肿瘤药物研发赛道的拥堵现状,药物制剂的改良创新将更加活跃。
作者贡献:王少红负责调研数据并撰写初稿;刘鑫负责数据核对;刘清扬负责文章的格式整理;唐彦负责文章修改;张波负责文章的立意及整体思路。
利益冲突:所有作者均声明不存在利益冲突。
参考文献
[1]Thomas S, Caplan A. The orphan drug act revisited[J]. Jama, 2019, 321(9): 833-834.
[2]HHS Food and Drug Administration.21CFR part 316 orphan drug regulations[J].Fed Reg,2013,78(113):35117-35135.
[3]Uchida K.Orphan drugs in Japan[J].Drug Information Journal,1996,30(1):171-175.
[4]European Medicines Agency.Regulation(EC)No 141/2000 of the European parliament and of the council of 16 December 1999 on orphan medicinal products[EB/OL].(1999-12-16)[2024-01-01].https://eur-lex.europa.eu/legalcontent/EN/TXT.
[5]国家卫生健康委员会, 科学技术部, 工业和信息化部, 等. 关于公布第一批罕见病目录的通知(国卫医发〔2018〕10号)[EB/OL]. (2018-05-11)[2024-01-01].http://www.nhc.gov.cn/yzygj/s7659/201806/393a9a37f 39c4b458d6e830f40a4bb99.shtml.
[6]国家卫生健康委员会, 科学技术部, 工业和信息化部, 等. 关于公布第二批罕见病目录的通知(国卫医政发〔2023〕26号)[EB/OL].(2023-09-18)[2024-01-01].http://www.nhc.gov.cn/yzygj/s7659/202309/19941f5eb0 994615b34273bc27bf360d.shtml.
[7]U.S. Food and Drug Administation.Search orphan drug designations and approvals[EB/OL]. (2024-01-01)[2024-01-01]. https://www.access-data.fda.gov/scripts/opdlisting/oopd/index.cfm.
[8] U.S. Food and Drug Administation.Novel drug approvals for 2023 [EB/OL]. (2024-01-01)[2024-01-01].https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2023.
[9]国家药品监督管理局.数据查询[EB/OL]. (2024-01-01)[2024-01-01].https://www.nmpa.gov.cn/datasearch/home-index.html#category=yp.
[10] PMDA.令和5年度承認品目一覧(新医薬品) [EB/OL].(2023-12-18)[2024-01-01].https://www.pmda. go.jp/review-services/drug-reviews/review-information/p-drugs/0036.html.
[11] PMDA.Database of approved and licensed drugs in Japan[EB/OL].(2024-01-01)[2024-01-01].https://www.drugfuture.com/pmda/.
[12]European Medicines Agency.Medicines[EB/OL]. (2024-01-01)[2024-01-01] https://www.ema.europa.eu/en/medicines.
[13] European Medicines Agency.Human medicines: highlights of 2023[EB/OL]. (2024-02-10)[2024-02-13].https://www.ema.europa.eu/en/documents/other/human-medicines-highlights-2023_en.pdf.
[14] 崔积钰,韩优莉.基于中美日新药上市现状对比的抗肿瘤新药发展策略研究[J].中国卫生政策研究,2021,14(8):52-59.
[15] 国家药品监督管理局.2023年度药品审评报告[EB/OL]. (2024-02-04)[2024-02-13].https://www.nmpa. gov.cn/xxgk/fgwj/gzwj/gzwjyp/20240204154334141.html.
[16] Gottlieb S.Rare disease day 2018[EB/OL].(2018-06-28) [2024-01-01].https://www.fda.gov/industry/fdas-rare-diseaseday/rare-disease-day-2018.
[17] U.S. Food and Drug Administation.CDER continues to make rare diseases a priority with drug approvals and programming to speed therapeutic development[EB/OL].(2022-03-04)[2024-01-01].https://www.fda.gov/news-events/fda-voices/cder-continues-make-rare-diseases-priority drug-approvals-and-programming-speed-therapeutic.
[18] European Medicines Agency.Legal framework: orphan designation[EB/OL].(2024-02-13)[2024-02-13].https://www.ema.europa.eu/en/human-regulatory-overview/orphan-designation-overview/legal-framework-orphan-designation.
[19] European Medicines Agency. Orphan incentives[EB/OL].(2022-12-12)[2024-01-01].https://www.ema.europa.eu/en/human-regulatory/research development/orphan-designation/orphan-incentives.
[20] 刘鑫,李建涛,张鹏霄,等. 中国孤儿药现状及与国外对比分析研究[J]. 中国药学杂志,2019,54(10):839-846.
[21] 国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《罕见疾病药物临床研究统计学指导原则(试行)》的通告(2022 年第33号)[EB/OL].(2022-06-02)[2024-01-01]. https://www.cde.org.cn/main/news/viewInfoCommon/058e0d665b785e79b7f4f24dc1dc970c.
[22]国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《罕见 疾病药物临床研发技术指导原则》的通告(2021年第71号)[EB/OL].(2021-12-31)[2024-01-01].https://www.cde.org.cn/main/news/view-InfoCommon/c4e1ef312a0a0c039a7a4ca55b 91d4e8.
[23] 国家药品监督管理局.《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》[EB/OL].(2022-05-09) [2022-12-15].https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjp/20220509220456183.html.


