孤儿药专栏|罕见病药物临床研发的审评考虑
罕见病研究
【摘要】罕见病单病种发病率极低,病情复杂,诊断难度大,这些因素导致罕见病药物临床研发面临诸多困难。中国在罕见病用药上存在迫切的临床需求,只有鼓励新药研发,特别是中国拥有自主知识产权的新药创新,才是解决中国罕见病患者的用药困境的根本举措。为进一步提高罕见病药物临床研发效率,国家药品监督管理局药品审评中心组织撰写了《罕见疾病药物临床研发技术指导原则》。这是中国首个从临床研发技术层面,针对罕见病起草的指导原则。该指导原则为药物研发单位提供了罕见病药物研发的科学思路与框架,旨在指导药物研发单位,在遵循一般药物研发规律的前提下,以科学为基础,结合罕见病自身特点,实现罕见病药物的合理、高效研发。本文将结合该指导原则中的研发理念,阐述当前对罕见病药物临床研发的审评考虑。
罕见病是发病率/患病率极低的一组疾病的统称。患病率低是罕见病的重要特征,由于中国人口基数庞大,罕见病患者的绝对数量并不少,对社会、经济、医疗等多方面均存在不容忽视的影响,是重要的公共健康问题之一。另一方面,由于罕见病发病率极低,病情复杂,目前对其认识相对有限,使得罕见病药物研发所面临的困难远远超过常见多发疾病,导致罕见疾病患者的治疗需求远未满足。
良好的政策是激励药物创新研发的重要动力。为解决罕见疾病这一重要的公共卫生问题,美国、欧盟等通过了鼓励罕见疾病研究和孤儿药物开发的相关立法。近年来,国家出台了多项针对罕见病药物创新的鼓励政策,旨在确保药品安全有效的前提下,要求监管机构加快审批速度。但与欧美国家不同,中国长期以来缺乏对于“罕见病”的官方定义,直至2018年5月,国家卫生健康委员会、科技部、工业和信息化部、国家药品监督管理局、国家中医药管理局等五部门联合发布《第一批罕见病目录》[1],这是国家层面首次官方认定罕见病;已出台的多项鼓励政策,在现阶段仍主要适用于在《第一批罕见病目录》中的疾病,例如,在《接受药品境外临床试验数据的技术指导原则》中所提及的“对于用于危重疾病、罕见病、儿科且缺乏有效治疗手段的药品注册申请,经评估其境外临床试验数据属于‘部分接受情形的,可采用有条件接受临床试验数据方式”,其中的“罕见病”即限定于《第一批罕见病目录》的疾病。
中国已发布的《第一批罕见病目录》共涉及121种罕见病,虽然已有多种罕见病治疗药物陆续在中国获批上市[2],但目前仍然有多种罕见病,特别是名单未覆盖的、发病率/患病率极低的疾病,在中国面临“境外有药,境内无药”的困境;另一方面,中国罕见病药物目前主要依靠进口及仿制药,因此只有鼓励新药研发,特别是中国拥有自主知识产权的新药创新,才是解决中国罕见病患者的用药困境的根本举措。
为进一步提高罕见病药物临床研发效率,国家药品监督管理局药品审评中心组织撰写了《罕见疾病药物临床研发技术指导原则》[3],并在2021年10月11日对外公开征求意见。这是中国首个从临床研发技术层面,针对罕见病起草的指导原则。值得注意的是,考虑到在中国尚无明确的罕见病定义,虽已发布了《第一批罕见病目录》,但尚不能涵盖所有发病率极低的疾病。为指导发病率极低的一类疾病的药物研发,而非仅限定于《第一批罕见病目录》中的疾病,因此在指导原则中,采用了“罕见疾病”的描述,以避免与《第一批罕见病目录》中“罕见病”的概念发生混淆。
1 罕见疾病药物临床研发的难点
由于罕见疾病单个病种的患者人数少,且通常具有病死率高、疾病类型复杂等特点,导致罕见疾病药物临床试验开展的挑战诸多,例如患者入组困难、诊断难度大、终点指标复杂、研究周期较长等;而另一方面,药品监管机构并不会因为罕见疾病药物临床研发难度大,而降低其上市的门槛;罕见疾病治疗药物的上市,仍需要以获得充分的证据,证明其对患者的获益大于风险为基本前提;因此药物研发单位对于罕见疾病药物研发的投入往往更高,而罕见疾病药物上市后患者人群较少,最终造成罕见疾病研发的投入回报率较低,导致企业对该类产品的研发、生产及注册申报缺乏积极性,研发动力不足。上述原因共同加剧了中国罕见疾病创新药的研发困境。
2 罕见疾病药物临床审评思考
药物研发的难点与药物研发的科学性之间,并非“不可兼得”的对立关系;《罕见疾病药物临床研发技术指导原则》的主旨就是提供一个罕见疾病药物研发的科学思路与框架,指导药物研发单位,在遵循一般药物研发规律的基础上,结合罕见疾病自身特点,在不损失科学性的基础上,实现罕见疾病药物的合理、高效研发。
2.1 罕见疾病药物研发的特殊考虑
2.1.1 获取罕见疾病临床数据
罕见疾病不但发病率极低,而且疾病类型繁多,表型复杂,临床表现多样化,患者人群可覆盖新生儿至老年患者,加之临床诊疗方面对其认知有限,目前积累的基础数据显著少于常见多发疾病,这为新药研发的临床试验设计和有效性评估带来很大挑战。为提高罕见疾病的药物研发效率,首要是鼓励关注罕见疾病的致病机制研究,为临床研发提供重要依据和研发方向[3]。
对于致病机制不明确或不够了解的罕见疾病,鼓励研发单位在计划开展药物研发之初,先对拟开发适应症开展临床调研,了解该疾病的患病率、诊断方法及其准确率、疾病症状/特征、主要发病人群以及治疗现状等,获得相对充分的疾病临床数据。从而为其参照罕见疾病药物研发思路开展后续临床研发提供合理性依据;也可为适应症人群的定义、关键研究设计、临床试验终点选择等提供有价值的信息;也可能作为后续临床研究中重要的外部对照数据。
由于罕见疾病的复杂性,单个研究有时很难全面的反映罕见疾病的临床特征,因此鼓励通过多种途径获得罕见疾病的临床数据,并鼓励开展研发单位间的交流与合作,提倡数据共享。
2.1.2 关注生物标志物的应用
生物标志物通常是指能被客观测量和评价,反映生理或病理过程,以及对暴露或治疗干预措施产生生物学效应的指标。罕见疾病患者人群小,难以开展大规模的临床试验,即使是开展了临床试验,也只能获得有限的有效性和安全性信息。由于多数罕见疾病的临床症状复杂多样,需要较长时间的药物干预才足以产生临床可识别的差异,因此,为了提高研发过程中识别药物干预产生的治疗效应或者安全性风险的敏感性,鼓励尽可能多的应用生物标志物,作为有限临床安全性和有效性数据的重要补充。例如,可利用安全性生物标志物,发现药物治疗中潜在的用药安全风险更高的患者;或利用药效学生物标志物,协助确定试验药物的合理给药方案;或开发可用于临床试验的替代终点等。
另一方面,还可以利用诊断性生物标志物,提高罕见疾病的确诊率,必要时需根据相关生物标志物开发伴随诊断[4]。对于需要应用伴随诊断精准定位用药人群的药物,通常药物和伴随诊断需同步获得药监部门的批准。
2.1.3 积极应用定量药理学工具
基于罕见疾病受试者有限,患者年龄跨度大的特点,鼓励在研发过程中充分应用定量药理学工具,提高研发效率。例如,建立群体药代动力学-药效学模型,有助于科学、高效的确定试验药物在罕见疾病中的推荐剂量;有助于利用成人受试者数据外推不同年龄段儿童患者推荐剂量;有助于确定在特殊人群的推荐剂量等。
2.1.4 鼓励建立患者登记系统
罕见疾病单病种患者少,临床数据通常较为分散,收集和获取具有代表性的罕见疾病的临床数据存在难度,因此鼓励建立标准化患者登记系统。通过患者登记系统,有助于获得相对完整、准确的高质量临床数据,为统计和分析奠定良好基础,也为基于真实世界研究增加罕见疾病相关适应症提供可能。
2.2 精巧的研究设计
2.2.1 纳入更广泛的人群
罕见疾病的主要特征是患者人群少,这也是导致药物研发难、临床试验推进慢的重要原因之一。关键研究应根据早期研究结果纳入具有代表性的患者,而早期研究中,如能尽早明确不同年龄段、特殊人群等患者的用法用量,则有利于在一个关键研究中纳入更加广泛、更加多样性的患者群体,降低受试者的招募难度。
因此在罕见疾病药物研发中,应特别关注科学工具的使用,例如,在探索研究阶段,应用模型引导的药物研发策略(model-informed drug development,MIDD)[5],明确各个年龄段的用法用量,明确不同肝肾功能水平的特殊人群的用法用量后,有助于在关键研究中,将儿童、成人作为整体患者人群进行临床试验,从而在关键研究中,纳入更广泛的患者群体。
需要强调的是,通常情况下,药物研发是在完成针对成人患者的研发后,再开展针对儿童患者的研发[6];对于罕见疾病药物,也应遵循相同的原则,以保障儿童受试者的权益。对于儿童、成人共患的罕见疾病,一般应在成人患者观察到疗效信号后,再开展儿童人群研究;对于仅儿童患病的罕见疾病,则建议首次人体临床试验选择健康成人为研究对象;对于极少数无法选择健康成年受试者,疾病人群仅为儿童,无成人患者可选择的特殊情况,应在充分评估安全性风险的前提下,谨慎地考虑在儿童患者开展首次人体试验。
2.2.2 合理选择药物剂量
在首次人体临床试验中,药物起始剂量的确定应遵循药理毒理相关指导原则和技术要求[7]。对于罕见疾病的替代治疗药物,由于对所缺乏的人体内源性物质的生理水平通常较为清晰,因此鼓励充分利用疾病的非临床研究和临床研究数据,建立替代治疗的药物剂量与所替代物质水平间的关系,在符合药理毒理相关技术指导原则对起始剂量要求,且安全可控的前提下,尽量选择接近于目标治疗剂量的水平作为起始剂量,以尽可能降低罕见疾病受试者的无效暴露,提高剂量探索研究的效率。
通过药物早期探索研究阶段,将最终明确药物的推荐剂量。推荐剂量是药物进入关键研究、预期未来上市后将采用的用法用量。通常,推荐剂量是根据早期研究中药物的药代动力学(pharmacokinetics,PK)、药效动力学(pharmacodynamics,PD)、安全性和初步有效性数据综合判断得出。在罕见疾病药物研发中,建议注重科学工具的使用,通过群体药代动力学研究,建立药代动力学-药效学模型等,实现从健康人到患者,或从成人患者到儿童患者,或从其他疾病患者到目标罕见疾病患者的剂量外推。对于作用机制明确的替代治疗,也可通过对PK-PD关系的充分研究,明确药物剂量-效应关系,从而确定推荐剂量。
2.2.3 敏感的疗效指标
与常见疾病药物的研发规律相似,当前罕见疾病临床研发中,临床终点仍是关键研究中支持药物上市的首选主要疗效指标。主要疗效指标应根据疾病特点及临床研究的主要目的选择,与临床获益具有高度相关性,还应具有客观性、敏感性、易量化、可重复等特点。对于罕见疾病而言,疗效指标的选择既要关注合理性及客观性以反映药物与临床获益的关系,也要特别关注疗效指标的敏感性;敏感的疗效指标可以在一定程度上将有助于减少试验所需的样本量。
由于罕见疾病药物研发经验有限,往往新药研发时,可供参考的既往案例有限。充分了解目标适应症人群的发病特点、临床表现、发展过程等,根据药物作用机制确定药物的治疗目标,有助于确定有意义、更敏感的临床终点。此外,鼓励在研发过程中,探索、开发与临床终点相关,对临床终点有预测价值的替代终点,通过敏感的替代终点,达到简化临床试验,提高研发效率的目的。
在罕见疾病药物研发中,特别强调关注患者报告结局(patient reported outcome,PRO)。PRO是临床结局的形式之一,在药物注册临床研究中得到越来越广泛的使用,并日益受到重视。在罕见疾病药物研发中,鼓励应用PRO,以反映药物对罕见疾病患者生活质量、体验的改善和其临床价值,并将其PRO作为对主要终点的重要支持性数据;鼓励开发PRO量表;也可考虑将PRO开发为主要终点,并与监管机构沟通将PRO作为主要终点支持监管决策的可行性[8]。
2.2.4 科学的研究设计
目前,药物研发中采用的临床试验设计包括同期平行对照研究、非同期外部对照研究、自身对照和真实世界研究等。
(1)同期平行对照研究。同期平行对照研究是确证药物疗效的金标准,因此平行对照研究是首选的试验设计。根据对照药的不同,可以分为安慰剂对照和阳性药对照。在安慰剂对照研究中,当长期安慰剂治疗不可接受时,也可考虑开展随机撤药试验。在随机撤药试验中,接受试验药物治疗且达到预期疗效的患者被随机分配继续接受试验药物治疗或接受安慰剂治疗。两组之间出现的任何差异将证明试验药物的治疗作用。对于目标适应症在国内已有药物获批上市并具有可及性,推荐使用阳性对照药。阳性对照研究通常可采用优效性设计或非劣效设计。当采用优效性设计时,药物前期探索性研究及阳性药在目标适应症中的疗效将为统计假设时试验组较对照药的预估疗效差异提供依据。当采用非劣效设计时,需关注非劣效界值设定问题,在恰当且必要的情况下,可适当放宽非劣效界值。建议在开展临床试验前与监管部门沟通,明确非劣效界值。
(2)非同期外部对照研究。对于具有高度未满足医疗需求的严重罕见疾病,可考虑通过外部对照的研究方法,非同期外部对照通常采用单臂研究设计,外部对照可以是平行的或历史的外部对照。然而,这种设计的主要问题是无法消除非同期治疗组间带来的系统差异。因此,当使用非同期外部对照时,原则上需同时满足以下条件:①临床实践中无有效治疗手段;或相较于现有治疗,早期数据显示试验药物具有突出疗效;②疾病进程清晰、可预测,可被客观地测定和验证(例如,当疾病本身存在自发缓解可能的疾病,不适合采用单臂试验设计);③疾病严重程度高,预后差; ④较高质量的外部对照数据。单臂试验较随机对照试验的证据级别低,试验结果存在一定的不确定性,因此当计划以单臂研究支持药物上市时,建议研发单位就单臂试验的适用性,上市后要求预先与监管机构进行沟通交流。
(3)自身对照研究。自身对照是历史对照设计的一种特殊类型,其历史数据来自于参与试验药物干预性临床试验的受试患者自身。需确保患者历史/基线数据的准确性。当采用自身对照设计时,首选建议是先开展前瞻性观察性研究,以观察性研究结果作为患者的基线数据,后续试验药物的干预性研究结果,与患者基线数据进行比较,以证实试验药物的疗效。
(4)真实世界研究。真实世界研究除了可作为单臂试验的外部对照数据外,还可用于支持已上市药物增加罕见疾病适应症。可参考相关指导原则开展真实世界研究[9-11]。
除上述临床试验设计以外,鼓励研发单位在研发中尝试其他更灵活的试验设计,如采用适应性设计、篮式设计、平台试验设计等;鼓励研发单位与监管机构开展积极沟通,例如当计划采用适应性无缝试验设计,特别是当研究的患者数量有限时,应在试验启动前与监管机构讨论全面的统计分析计划,包括试验设计和预先计划分析的关键特征。
2.3 对样本量的考虑
罕见疾病患者人群少是造成罕见疾病药物研发困难的重要原因之一,因此对于罕见疾病药物研发中样本量的考虑,是研发单位最为关注的问题。
对样本量提出要求的最终目的,是确证药物在目标适应症中的有效性和安全性,从而全面、客观、科学地对获益风险进行评估。因此,从有效性角度来看,原则上,罕见疾病药物的关键研究设计的样本量需要根据统计学相关原则,基于对于主要终点的统计假设而确定。由于罕见疾病患者本身临床表现及生理状态等方面差异较大,而关键研究中纳入更加广泛的患者可能会使研究人群的变异度进一步增加,因此选择敏感的主要终点指标、采用更灵活的试验设计,会有助于减少样本量。
从安全性角度来看,对样本量要求,是通过必要的患者暴露,而获得对药物安全性的基本认识。对于治疗具备慢性病特征、需长期治疗的罕见疾病,通常需遵循ICH E1的要求。罕见疾病患者人数少,安全性数据可同时包含其他来自非罕见疾病人群的数据。
2.4 药物研发的全盘计划
临床试验的最终目标是证明药物在适应症人群中的疗效明确、安全风险可控、且获益大于风险。由于罕见疾病患者少,在关键研究中可获得来自受试者的数据也相应有限,特别是在一些无法开展循证医学级别更高的对照研究的情况下,通过疾病机制、药物机制以及在其他非罕见疾病中获得临床试验数据,共同丰富、完善该药物在罕见疾病中有效、安全性的“证据链”,就格外重要。例如,单臂试验通常仅支持药物的附条件批准,而在一些特殊情况下,例如药物作用机制非常明确,药物作用机制的有效性已在其他适应症中得到确证时,也可能支持完全批准。再如,对于预期只能用于罕见疾病治疗的药物,当其靶点明确、作用机制非常清晰时(如替代疗法),基于患者获益风险的评估,可能会减少对暴露量的要求。
因此,对于罕见疾病药物的研发,我们鼓励在药物研发初期就进行全盘规划。根据罕见疾病药物的作用机制,可以分为两种情况:(1)只适用于目标罕见疾病;(2)同时适用于罕见疾病和非罕见疾病。
对于仅适用于罕见疾病的试验药物,通常需参考一般药物研发规律,开展早期探索研究,完成概念验证,确定推荐剂量、目标人群,获得初步有效性数据后,以此为基础开展关键研究,支持药物的上市。由于罕见病受试者有限,有时很难开展独立的概念验证研究,因此鼓励将关键研究分阶段开展,在第一阶段入组小样本量受试者,作为概念验证,并以此阶段结果为基础,对后续试验阶段进行调整,最终将第一阶段和后续研究阶段中,接受推荐剂量治疗的患者整体的有效性,作为支持上市的关键疗效数据。
对于适用于包括罕见疾病和非罕见疾病在内的多种疾病的药物,早期可以采用篮式试验设计,纳入多种疾病人群,并充分借鉴、利用在非罕见疾病中获得的临床数据,指导确定该药物在罕见疾病中的开发,根据在其他疾病所获得临床数据对罕见疾病适应症开发的指导价值,可考虑直接开展在罕见疾病适应症中的概念验证临床试验,或直接进入关键临床试验;当直接进入关键临床试验时,可参考前述适应性设计思路。
图1 罕见疾病药物临床研发计划示例
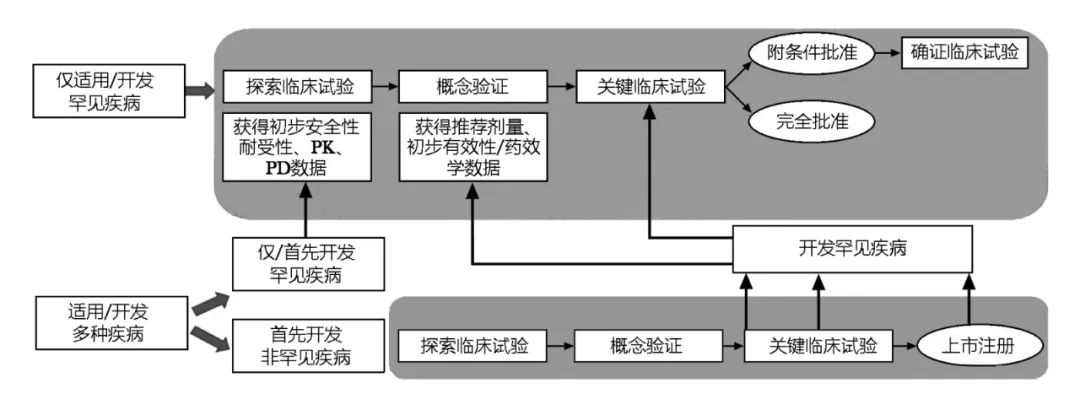
适用于包括罕见疾病和非罕见疾病在内的多种疾病的药物也可以选择首选开发罕见疾病,此时需参考情况“(1)只适用于目标罕见疾病”的情况进行开发。
罕见疾病复杂,病种繁多,药物研发难度较大,建议在开展罕见疾病药物研发工作时,对研发计划进行全盘考虑。鼓励研发单位在研发过程中积极与监管机构就药物研发计划进行沟通交流。
3 总结
罕见疾病发病率极低,病情复杂,诊断难度大;罕见疾病患者人数有限,因此开展临床试验难度较大,这些因素导致罕见疾病药物临床研发面临诸多困难。然而罕见疾病药物研发仍应以科学为基本准则,可以通过精巧科学的方法“精简”研究设计,但不能以降低科学标准为代价“简化”研发过程。罕见疾病药物研发除了应遵循一般药物的研发规律以外,更应密切结合罕见疾病自身特点,在研发初始,对罕见疾病药物研发进行全盘规划,在研发过程中,关注科学研发新技术、新方法的使用,探求更科学和精巧的研究方法,以提高研发效率。
参考文献
[1]国家卫生健康委、科学技术部、工业和信息化部,等.关于公布第一批罕见病目录的通知(国卫医发〔2018〕10号)[EB/OL].(2018-05-11)[2021-12-05].http://www.gov.cn/zhengce/zhengceku/2018/12/31/content_5435167.htm.
[2]王雪, 赵聪, 许淑红,等.我国罕见病用药可及性现状分析[J].中国临床药理学杂志,2021, 37: 1026-1032.
[3]国家药品监督管理局药品审评中心. 关于公开征求《罕见疾病药物临床研发技术指导原则》意见的通知[EB/OL].(2021-10-11)[2021-12-05].https://www.cde.org.cn/main/news/viewInfoCommon/c8ab88e8573500b49c1d48853ab8b4fc.
[4]国家药品监督管理局.国家药品监督管理局关于发布用于罕见病防治医疗器械注册审查指导原则的通告(2018年第101号)[EB/OL].(2018-10-12)[2021-12-05].http://www.gov.cn/xinwen/2018-10/19/content_5332326.htm.
[5]国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《模型引导的药物研发技术指导原则》的通告(2020年第59号)[EB/OL]. (2020-12-31)[2021-12-05].http://www.cde.org.cn/news.do?method=large Info&id=098341fe2a636c47.
[6]国家药品监督管理局药品审评中心. 关于征求《儿科人群药物临床试验技术指导原则》意见的通知[EB/OL].(2015-08-04)[2021-12-05].https://www.cde.org.cn/main/news/viewInfoCommon/47 fa6b133a831c5392111cc33cbaa042.
[7]张凤琴, 孙涛, 王海学,等. 新药人体首次剂量设计的技术考虑[J]. 中国新药杂志,2020,29:1456-1463.
[8]国家药品监督管理局药品审评中心. 关于《患者报告结局在药物临床研究中应用的指导原则(征求意见稿)》公开征求意见的通知[EB/OL].(2021-09-03)[2021-12-05].https://www.cde.org.cn/main/news/viewInfoCommon/0d 57bc91690c53db3d224e546 bfda06f.
[9]国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《用于产生真实世界证据的真实世界数据指导原则(试行)》的通告(2021年第27号)[EB/OL].(2021-04-15)[2021-12-05].
https://www.cde.org.cn/main/news/viewInfoCommon/21a2a1c437ed54e7b838a7e86f4ac21c539.
[10]国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》的通告(2020年第22号)[EB/OL].(2020-08-31)[2021-12-05]. https://www.cde.org.cn/main/news/viewInfoCommon/6906389100848948deb49a484197902.
[11]国家药品监督管理局药品审评中心. 关于公开征求《真实世界证据支持药物研发的基本考虑》意见的通知[EB/OL].(2019-05-29)[2021-12-05].https://www.cde.org.cn/main/news/viewInfoCommon/7e6fb9fc3f066a966a02130f24dbff1c.


