专家笔谈 | 中国新生儿遗传代谢病筛查现状及展望
中国罕见病联盟
【摘要】新生儿筛查是早发现、早治疗罕见遗传病的有效措施,在降低出生缺陷的三级预防措施中,新生儿筛查预防效果显著,并随着新疗法和新技术的进步而不断发展。新生儿筛查也是获得罕见病患病率数据的较为可靠方法。本文介绍了中国新生儿遗传代谢病筛查的历史和现状,分析了7 819 662例串联质谱法多种遗传代谢病新生儿筛查确诊的疾病普及患病率,提出12种罕见病作为中国串联质谱法新生儿筛查首选目标疾病。对未来的新生儿基因筛查提出了技术发展的要求和伦理的思考。
确定罕见病的一大困难是缺乏对疾病发病率的了解,不同国家或地区都用疾病发病率概念或定义来归类罕见病。目前纳入罕见病范畴的疾病不全是流调结果,发病率数据有些也并不可靠。中国公布的《第一批罕见病目录》包含121种罕见病,其中有新生儿发病资料的29种,占24%1。罕见病的发病率可通过注册登记、真实世界研究等手段进行了解,罕见病的患病率则可通过新生儿筛查、杂合子筛查等方法了解或者统计。新生儿筛查是获得罕见病患病率数据的重要手段。
新生儿遗传代谢病筛查是指对新生儿人群,在出生后数天内通过测定特异代谢物筛查遗传代谢病,使患有遗传代谢病的新生儿在临床症状出现之前得到诊断和治疗2-3。新生儿筛查是当今国际上早期发现罕见遗传病患儿的有效措施,在降低出生缺陷的三级预防措施中,是目前预防效果显著,成本效益最佳措施之一。疾病的早诊断、早治疗、早预防可降低死亡率和残疾的发生,对减少出生缺陷有重大意义。另外,新生儿筛查也是较为可靠的罕见病流行病学调查方法。世界各国,包括中国,都把可以早期筛查、早期诊断,能够预防的遗传代谢病纳入罕见病目录优先进行重点防控,同时在提高罕见病的诊疗水平、完善罕见病的社会保障制度、推动罕见病药品开发等方面给予重点支持。本文重点对目前中国罕见遗传代谢病新生儿筛查现状及未来发展展开讨论。
1 中国罕见遗传代谢病新生儿筛查现状
在种类繁多的遗传代谢病中,除了个别疾病,例如葡萄糖-6-磷酸脱氢酶缺乏症在中国南方,或者在特定区域患病率较高外,绝大多数遗传代谢病,例如氨基酸、有机酸、脂肪酸、碳水化合物等代谢病、溶酶体贮积病等都属于罕见病。
新生儿筛查已成为当今国际上及早发现遗传病患儿的有效措施。自20世纪60年代初开始的新生儿筛查,以细菌抑制法检测干滤纸血片中苯丙氨酸的浓度筛查苯丙酮尿症(phenylkitonuria,PKU),开创了新生儿疾病筛查的历史,随后先天性甲状腺功能减低症,以及以后发展的近20~40种疾病筛查在全世界主要国家不断开展。酶联免疫法、荧光法等技术的不断发展,使更多的疾病得到筛查和预防,全世界上百万的患儿在新生儿期得到及时诊断和治疗,幸免于各种严重临床后果。经过近60年的国内外实践和推广,已经取得巨大成功。
1981年新华医院在国内率先开展了新生儿筛查。上海市也是国内最早实行新生儿疾病筛查制度的城市,1990年市卫生局文件明确上海市实行新生儿疾病筛查制度,1999年在国内最早实行新生儿筛查标本递送的绿色通道。2002年新华医院在国内最早开展串联质谱新技术进行新生儿多种遗传代谢病筛查研究,逐步获得了上海地区的患病率、疾病谱和疾病的基因突变谱,并推动该技术在国内的普及。2007年上海市在PKU、先天性甲状腺功能减低症新生儿筛查的基础上增加了葡萄糖-6-磷酸脱氢酶缺乏症和先天性肾上腺皮质增生症的筛查,进一步加强了对可防、可治遗传病的早期防控。
最近20余年,串联质谱作为一项高新技术,可高通量、快速检测氨基酸代谢紊乱、有机酸代谢紊乱和脂肪酸氧化代谢障碍疾病,能对标本一次进行几十种疾病的筛查检测,实现了“一次实验检测几十种疾病”的目的,成为遗传代谢病检测的重要方法。将串联质谱技术应用于新生儿疾病筛查,检测的遗传性代谢病阳性率为1:3000~1:6000。串联质谱技术筛查的疾病,可通过饮食治疗或药物治疗,避免或者减轻疾病的危害。由于串联质谱法对多种遗传代谢病新生儿筛查具有较好的经济效益和社会效益,这项提高出生人口素质的新技术在国内外得以不断推广,每年约有数千万的新生儿得到筛查4。
目前中国已有100多家新生儿筛查中心采用串联质谱法进行多种遗传代谢病筛查。由于地区与人种的差异,中国人遗传代谢病病种与国外有一定差别。同时,由于中国幅员辽阔,筛查病种资料也显示地区间病种和患病率之间有差异。2018年,中国新生儿筛查专家组为配合《新生儿筛查技术规范》修改,在全国进行了串联质谱法新生儿多种遗传代谢病筛查的调查。在筛查量大于3万例的32家中心中收集到7 819 662例新生儿结果,统计共确诊患者2480例,以生化指标判断共计36种疾病,患病率大于1/50万有17种疾病,大于1/100万有25种疾病,大于1/200万有30种疾病,总患病率在1/3153(表1)。其中患病率较高的前3种疾病是高苯丙氨酸血症、甲基丙二酸血症和原发性肉碱缺乏症,分别属于氨基酸代谢病、有机酸代谢病和脂肪酸氧化代谢障碍疾病。
表1 中国7 819 662例串联质谱法多种遗传代谢病新生儿

在筛查病种选择方面,中国新生儿筛查相关专家根据目前新生儿筛查的状况、诊治条件、诊治能力及初步调查得到的疾病谱和患病率,结合疾病的危害性、检测方法敏感性和特异性、筛查病种选择原则等,推荐12种罕见病作为中国串联质谱法多种遗传代谢病新生儿筛查首选目标疾病,具体疾病的筛查指标及诊治原则见表2。
2 遗传代谢病新生儿筛查展望
国际上新生儿遗传代谢病筛查从苯丙酮尿症开始,之后陆续增加先天性甲状腺功能减低症、先天性肾上腺皮质增生症、葡萄糖-6-磷酸脱氢酶缺乏症等数十种疾病,然后又扩大到了听力障碍筛查、严重的先天性心脏病筛查,近年单个遗传病的基因筛查也在推广(严重联合免疫缺陷病、脊髓性肌萎缩症)。2006年美国医学遗传学会推荐核心新生儿筛查疾病为29种,之后又陆续增加了6种:糖原累积病Ⅱ型(庞贝病)、严重的先天性心脏病、严重联合免疫缺陷病、黏多糖贮积症I型、X-连锁肾上腺脑白质发育不良、脊髓性肌萎缩症,推荐的疾病达到35种5(表3)。以新生儿基因组进行高通量测序的BabySeq项目也在探索6-7。中国遗传代谢病新生儿筛查主要筛查苯丙酮尿症和先天性甲状腺功能减低症,有的地区增加了先天性肾上腺皮质增生症以及串联质谱法多种遗传代谢病筛查,筛查数量2~40余种疾病不等。
表2 12种串联质谱法多种遗传代谢病新生儿筛查的指标及诊治原则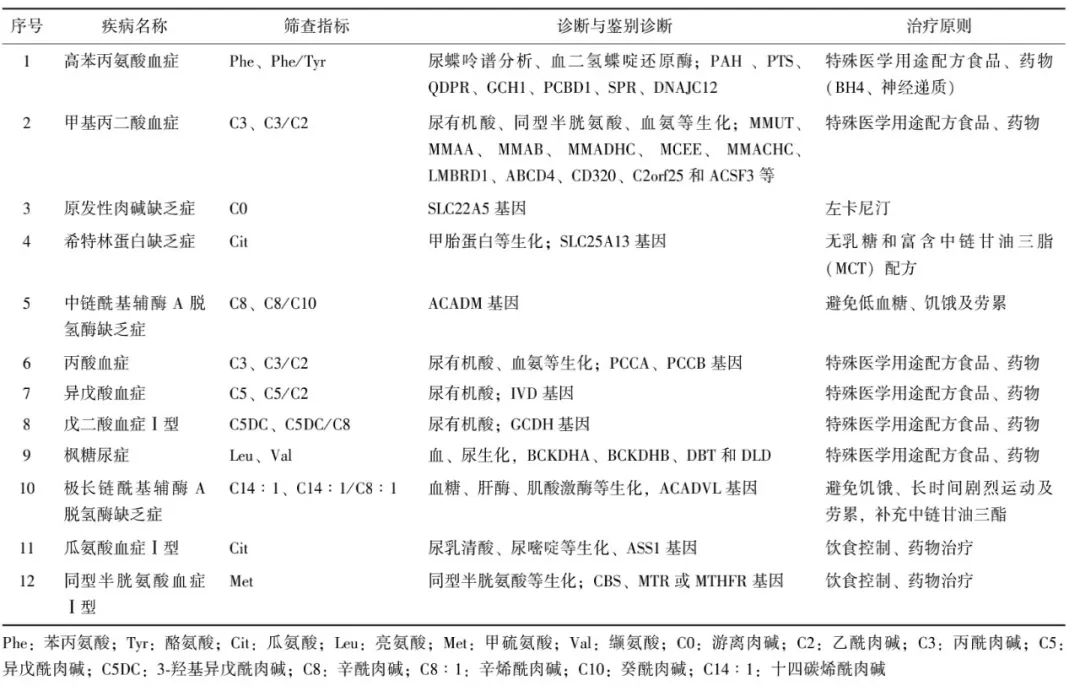
表3 美国医学遗传学会推荐的35种核心筛查的新生儿疾病5

新生儿筛查的发展使罕见遗传代谢病得到早发现、早诊断,为早治疗打下了基础,但要在全国推广,政府的公共卫生政策推动是关键,需要在国家和省级层面制定统一的串联质谱法多种遗传代谢病筛查的疾病谱,需要有后续确诊疾病、治疗疾病的诊疗共识,规范新生儿筛查、诊疗、随访、统计以及管理等各个环节的质量控制,保证每个筛查患者得到良好的治疗和管理。
中国开展新生儿筛查已有40年,构成了覆盖全国的新生儿筛查网络,覆盖率已达98%以上。但存在筛查疾病少,筛查实验室质量管理需要进一步提高的问题;存在筛查阳性患者尽早诊断、尽早开始治疗、长期管理的问题。面对预防医学的快速发展和新生儿人群对健康未来的迫切要求,对于新生儿筛查的技术方向提出以下几点建议:
第一,生化技术在未来一段时间内仍是新生儿筛查的主流技术。生化方法筛查靶向性强,时间分辨荧光免疫法、酶联免疫吸附法、荧光酶免疫分析法等技术的单个生化指标筛查目前仍是主流技术,但存在筛查疾病单一、防控效率低的问题。串联质谱法多种遗传代谢病的筛查在中国应用已近20年,形成了一定规模的技术力量和专家队伍,多地已有开展串联质谱法多种遗传代谢病筛查的经验,进一步的推广需要政策导向和技术培训。更多代谢物测定的代谢组学方法有待于技术的不断发展。
第二,针对溶酶体贮积病的多联酶活性生化筛查需要进一步拓展。国内对包括戈谢病、糖原累积病Ⅱ型、尼曼匹克病A/B型、黏多糖贮积病Ⅰ型、法布雷病、球形细胞脑白质发育不良等6种疾病的多联酶活性新生儿筛查开展了初步研究,相比单一溶酶体贮积病的生化筛查,多联酶活性筛查技术方法精准,效率更高,性价比更高。国内初步资料显示溶酶体贮积病总体患病率较高,在1:2000~1:4000(未发表数据)。临床经验提示早诊断、早治疗患者的疗效和预后相比临床发病后诊断的患者更好。建议溶酶体贮积病的多联酶活性生化筛查在国内开展更多的前期研究,尽早形成新生儿溶酶体贮积病筛查、诊治和疾病管理共识,推动解决患者后续的治疗保障,使患者的生活质量通过早诊断、早预防获得更好的改善。
第三,生化诊断和基因诊断的结合是精准诊断的需要。生化方法诊断的遗传代谢病,在基因组学层面的进一步检测,不仅有必要,而是必需的诊断手段。基因诊断可以弥补单纯生化筛查数据的不稳定性,以及在饮食、疾病等因素影响下存在的假阳性和假阴性结果。目前生化和基因检测两种技术的结合可以更有效、更精准地诊断到筛查的目标患者。根据代谢通路,既有一个生化指标对应一个致病基因,也有一个生化指标对应数个不同的致病基因,例如,导致甲基丙二酸血症的标志物丙酸肉碱升高,对应的致病基因有10个以上,生化技术无法进行精准的分型诊断,建议所有遗传病都应该同时进行基因检测,明确遗传病因、遗传方式,进行精准的遗传咨询及治疗。
另外,随着越来越多遗传病治疗新方法开展和罕见病新药的不断问世,符合新生儿筛查原则的罕见病将越来越多,而目前基于代谢物、酶学等生化方法筛查的疾病数量有限;还有些遗传病,例如严重联合免疫缺陷病、脊髓性肌萎缩症等疾病没有特异的代谢物,无法通过生化方法对疾病进行早期筛查,只能在临床症状出现后再进行基因检测,延误了最佳治疗。因此未来的筛查技术,特别是基因筛查值得关注与重视,代谢组学技术与基因组学技术的结合是未来的新生儿筛查方向。
3 对新生儿基因筛查的思考
国际人类基因组数据库已经收录了超过八千种的遗传病,在基因结构上主要有染色体数目异常、拷贝数异常(copy number variations,CNV)、小的插入和重复(insertion-deletion, InDel)和各种单核苷酸变异(single nucleotide variant,SNV),这些包含了孟德尔疾病相关的变异目前分为致病性的、可能致病性的、意义不明确的(variants of uncertain significance,VUS)、可能良性的或良性的5个不同等级8。致病性和可能致病性变异导致的疾病涉及人体各系统和器官,包括神经、精神、内分泌、免疫、消化、血液、肾脏、泌尿、骨骼、皮肤、眼、耳等各专业。基因检测不仅可在分子水平诊断疾病、预测疾病,还可检出致病基因携带者,在遗传咨询、产前诊断、治疗指导、预测表型等方面发挥关键作用2,9。
近年,罕见病的治疗进展较快,越来越多的罕见病药物进入国内或上市,部分进入了国家医保药品目录。伴随着基因测序费用的不断降低,将高通量基因测序引入新生儿筛查已成为发展所趋。在特定疾病靶基因或基因包(Panel)筛查、全外显子组测序(whole exome sequencing,WES)筛查、全基因组测序(whole genome sequencing,WGS)筛查方面,针对新生儿期可诊断、可干预或者预防的疾病,涵盖数十种至数百种遗传病进行筛查,在技术不断完善的当今及未来,有着广阔的前景10。
目前新生儿基因筛查主流技术是二代测序技术(next generation sequencing,NGS),优点是疾病覆盖广,但对检测到海量变异位点的致病性判读面临很大挑战。变异位点的致病性判读主要基于已报道的临床病例、实验室数据库,生物信息学方法的预测还只能提供辅助支持证据。虽然国内外形成了比较完善的位点致病性判读指南和共识,但还不能满足新生儿预测性诊断的要求,包括罕见或稀有变异位点的致病性、致病的严重程度、临床表型发病阶段、基因型-表型严格相关性、缺乏中国人群关于全基因组测序的大样本系统研究等,已知致病变异的假阳性和假阴性报告时常发生。另外,目前分析的自动化程度、筛查的检测报告时间还无法满足新生儿大规模筛查要求。
最近几年,笔者单位在新生儿基因筛查方面做了初步尝试11-13,采用了高通量测序、SNP-array基因芯片以及飞行质谱等技术,虽然都比以往的Sanger测序有着快速简便的优点,但目前各种商业化的高通量基因筛查技术,包括NGS技术、SNP-Array微阵列芯片、Mass飞行质谱等均无法全面满足新生儿基因筛查的临床需求。
根据目前各种基因检测技术的性能和局限性,为全面满足今后新生儿基因筛查的需要,我们期待国内科学家与企业合作,研发一种能兼具各平台优势,如NGS通量大和基因芯片分析快速、灵敏、可靠等特性的适合新生儿基因筛查的“傻瓜”型智能检测平台,在技术上需要满足以下几点:
(1)容量足够大的固相芯片,检测类型全面,覆盖已知全基因组的各种致病变异,包括CNV、InDel、SNV,一次实验即可检测包括染色体病、基因组病和单基因病在内的遗传病;
(2)探针的敏感性和特异性高,要包含已知公认的导致致死、致残、致愚等危害较大的致病性位点,基因型与表型明确,避免VUS位点;
(3)实验质控标准要明确,重复性好,性能稳定,每次带来高质量的一致数据;
(4)芯片检测和生信数据分析门槛低,可自动按照相关指南或共识准确进行致病变异评级,报告信息准确、全面、快速,适合大规模新生儿基因筛查;
(5)芯片的成本要比NGS低,具有较高的成本/效益比;
(6)定制芯片可根据数据库的更新,实现不断更新升级,增加新发现的罕见致病性变异,最终使“新生儿基因筛查”转变为“新生儿遗传病诊断性筛查” ;
(7)适用于各种样本类型检测,尤其是滤纸干血片及外周血;
(8)设备自动化程度高,机械臂替代繁琐的人工操作,可实现无人值守的全自动过夜运行并易于维护;
(9)设备检测量通量大,要适合新筛中心大样本量的筛查需求。
人类基因组DNA由超过30亿个碱基对组成,并且每个人与人类参考序列相比具有数百万个差异。目前对基因序列变异与疾病相关性的认知程度还远不足,高通量测序技术用于新生儿群体筛查,在技术上求多、求全,甚至把全部基因组筛查一遍,必然会带来诸多技术问题和伦理问题。比如基因组范围测序将产生关于每个婴儿的大量信息,哪些信息要告知?哪些信息可以不告知?如何告知?一旦新生儿基因测序完成,应该如何处理这些数据,这些可能揭示重要医学或社会问题的数据如何长期保存和保密,定期分析的必要性、所有权等值得进一步深入探讨和规范。由于基因组测序比传统筛查技术产生更多关于个体的信息加剧了这些问题的挑战,家长会对致病基因携带、晚发遗传病及肿瘤相关的“意外发现”告知发生恐慌。至少,新生儿基因筛查需要确保父母有足够的,可以清楚理解的有关筛查计划的信息,并且筛查患者都可以获得确诊和治疗服务,包括遗传咨询。因此,新生儿基因筛查技术的应用要与社会伦理的发展、科普教育共同推进,社会大众需要达成一定共识,新生儿基因筛查的高参与率和广泛的公众支持至关重要14-16。建议在发展符合中国国情的新生儿基因筛查原则及共识同时,经伦理委员会批准后,可以先行小规模的新生儿基因筛查探索,并加强后继的治疗干预、临床随访、遗传咨询、公共和专业教育以及行政监管17。
随着社会文明和经济的发展,中国的出生缺陷防控和共同富裕的政策,为新生儿筛查的发展开辟了广阔的前景。回顾新生儿筛查在中国走过的发展路程,展望未来,我们坚信随着遗传病三级防控技术的发展及国家对罕见病的重视,新生儿遗传病患者的生命质量和生活质量会随着医学发展的提高不断改善。让罕见病更罕见,让每个新生儿有一个美好的未来是我们的愿望和发展的动力。
【参考文献】
[1]全国罕见病学术团体主委联席会议.中国罕见病定义研究报告(2021).2021:13.
[2]顾学范.临床遗传代谢病[M].北京: 人民卫生出版社,2015.
[3]赵正言,顾学范.新生儿遗传代谢病筛查[M].第2版. 北京: 人民卫生出版社,2015.
[4]Wiley V, Webster D, Loeber G, et al. Screening Pathways through China, the Asia Pacific Region, the World[J]. Int J Neonatal Screen, 2019, 5: 26.
[5]美国医学遗传学会.新生儿统一筛查项目[EB/OL].(2022-01)[2022-01-31].http://www.hrsa.gov/adusorycommittees/mchbadusory/heritabledisorders/index.html.
[6]Holm IA, Agrawal PB, Ceyhan-Birsoy O,etal.The BabySeq project: implementing genomic sequencing in newborns[J]. BMC Pediatr,2018, 18:225.
[7]Ceyhan-Birsoy O, Murry JB, Machini K, et al. Interpreta-tion of Genomic Sequencing Results in Healthy and Ⅲ Newborns: Results from the BabySeq Project[J]. Am J Hum Genet, 2019,104:76-93.
[8]Jarvik GP, Browning BL. Consideration of cosegregation in the pathogenicity classification of genomic variants[J]. Am J Hum Genet, 2016,98:1077-1081.
[9]邬玲仟,张学.医学遗传学[M]. 北京:人民卫生出版社,2016.
[10]Berg JS, Agrawa PB, Bailey DB, et al. Newborn Sequenc-ing in Genomic Medicine and Public Health[J].Pediatrics,2017,139:e20162252.
[11]Luo X, Wang R, Fan Y,et al. Next-generation sequencing as a second-tier diagnostic test for newborn screening[J]. J Pediatr Endocrinol Metab, 2018,31:927-931.
[12]Luo XM, Sun Y, Xu F, et al.A pilot study of expanded newborn screening for 573 genes related to severe inherited disorders in China: results from 1,127 newborns[J].Ann Transl Med,2020,8:1058.
[13]Dai W, Yang T, Wang Y, Zhao Q, et al.Rapid detection of twenty-nine common Chinese glucose-6-phosphate dehydrogenase variants using a matrix-assisted laser desorption/ionization-time of flight mass spectrometry assay on dried blood spots[J].Clin Biochem, 2021,94:27-34.
[14]Schwartz TS, Christensen KD, Uveges MK et al. Effects of participation in a U.S. trial of newborn genomic sequencing on parents at risk for depression[J]. J Genet Couns, 2021. doi:10.1002/jgc4.1475.
[15]Pereira S, Smith HS, Frankel LA, et al.Psychosocial effect of newborn genomic sequencing on families in the babyseq project: a randomized clinical Trial[J]. JAMA Pediatr, 2021, 175:1132-1141.
[16]Kaiser J. Sequencing every newborns genome to detect diseases faces ethical and practial obstacles, but the United Kingdom is pushing ahead with a major test[EB/OL].(2021-09-23)[2022-01-31].https://www.science.org/content/article/sequence-every-newborn-s-dna-despite-obstacles-uk-pushes-ahead.
[17]Milko LV, Chen F, Chan K, et al.FDA oversight of NSIGHT genomic research: the need for an integrated systems approach to regulation[J]. NPJ Genom Med, 2019, 4:32.


